▼
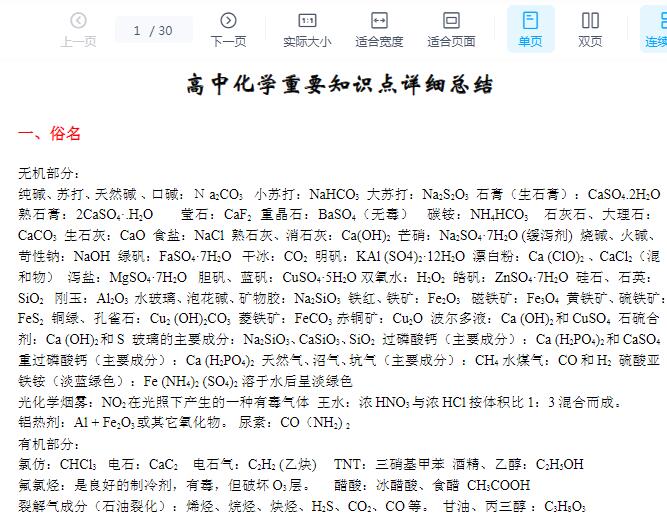
1. 核磁共振仪:有机物中处于不同化学环境的氢原子种类;3. 紫外光谱仪:有机物中的共轭结构(主要指苯环);4. 质谱仪:有机物的相对分子质量,对测定结构也有一定的帮助;5. 原子吸收(发射)光谱仪:测定物质的的金属元素,也可测定非金属元素;6. 分光光度计:测定溶液中物质的成分以含量,重点是测反应速率;7. 色谱分析仪:利用不同物质在固定相和流动相中分配比的不同,对物质进行分离,主要分类物理性质和化学性质相近的物质,纸层析就是其中的一种;8. 李比希燃烧法:测定有机物中C、H、O、N、Cl的有无及含量,CO2、H2O、N2、HCl;9. 铜丝燃烧法:测定有机物中是否含卤素,火焰为绿色说明含有卤素;10. 钠熔法:测定有机物是否含有X、N、S,NaX、Na2S、NaCN;12. 扫面隧道显微镜:观察、操纵物质表面的原子和分子;
2. 汤姆生:在阴极射线实验基础上提出“葡萄干面包式”模型;3. 卢瑟福:在α粒子散射实验基础上提出“核+电子”模型;3. 人造丝、人造毛、人造棉、黏胶纤维、铜氨纤维主要成分都是纤维素;6. Al2O3:人造刚玉、红宝石、蓝宝石的主要成分;7. SiO2:硅石、玻璃、石英、玛瑙、光纤的主要成分;9. 新型无机非金属材料:氧化铝陶瓷、氮化硅陶瓷、碳化硼陶瓷、光纤等;具有耐高温、强度大的特性,还具有电学特性、光学特性、生物功能;11. 新型高分子材料:高分子膜、尿不湿、隐形眼镜、人造关节、心脏补片、液晶材料等;12. 三大合成材料:合成塑料、合成纤维、合成橡胶;
石油的分馏是物理变化,石油的裂化、裂解都是化学变化3. 生物质能:通过光合作用,太阳能以化学能的形式贮藏在生物质中的能量形式;木材、森林废弃物、农业废弃物、植物、动物粪便、沼气等;
2. 温室效应:大气中CO2、CH4增多,造成全球平均气温上升;3. 光化学烟雾:NxOy在紫外线作用下发生一系列的光化学反应而生成的有毒气体;7. 室内污染:HCHO、苯、放射性氡、电磁辐射;8. PM2.5:直径≤2.5μm(2.5×10-6m)能在空中长时间悬浮,颗粒小,表面积大,能吸附大量有害有毒物质(如金属、微生物);雾霾天气的形成于部分颗粒在空气中形成气溶胶有关
9. 非法食品添加剂:吊白块、苏丹红、三聚氰胺、硼酸、荧光增白剂、瘦肉精、工业明胶;10. 腌制食品:腌制过程中会产生亚硝酸盐,具有致癌性;11. 地沟油:地沟油中有黄曲霉素,具有致癌性;可以制肥皂盒生物柴油;12. 绿色化学:绿色化学是指化学反应及其过程以“原子经济性”为基本原则,即在获取新物质的化学反应中充分利用参与反应的每个原料原子,实现“零排放”。绿色化学的目标是研究和寻找能充分利用的无毒害原料,最大限度地节约能源,在化工生产的各环节都实现净化和无污染的反应途径;丙糖:甘油醛(最简单的糖)CH2(OH)CH(OH)CHO①淀粉(C6H10O5)n和纤维素(C6H10O5)n,n值是一个区间,故两者不是同分异构体,都是混合物;a.尚未水解:必须先加NaOH中和硫酸,再加入新制氢氧化铜加热,无砖红色沉淀;c.取两份,一份加入碘水呈蓝色;一份加入NaoH中中和硫酸后,再加入新制氢氧化铜加热,有砖红色沉淀③人体中无纤维素酶,不能消化纤维素,多吃含纤维素食物可促进肠道蠕动;1. α-氨基酸:氨基和羧基连在同一个碳上
固体氨基酸主要以内盐形式存在,所以具有较高的熔沸点,且难溶于有机溶剂;两个不同的氨基酸缩合形成二肽,有四种不同的产物(两个自身,两个交叉);3. 分离:当氨基酸以两性离子存在于溶液中时,其溶解度最小,而不同的氨基酸出现这种情况的pH各不相同,故可利用此差异,通过调节溶液的pH值来分离氨基酸;4. 盐析:许多蛋白质在水中有一定的溶解度,溶于水形成胶体;在浓度较高的低盐金属盐(Na2SO4)或铵盐中,能破坏胶体结构而使蛋白质溶解度降低,从而使蛋白质变成沉淀析出,析出的蛋白质仍具有生物活性;①重金属盐、强酸、强碱、甲醛、酒精等可使蛋白质变性而失去活性,析出的蛋白质不再溶于水;②当人体误食重金属盐时,可喝大量的牛奶、豆奶、鸡蛋清来解毒;
1. 油脂不是高分子,是由高级脂肪酸与甘油形成的酯类;2. 油:不饱和脂肪酸甘油酯,常温液态,如豆油、花生油;能使溴水退色;不能从溴水中萃取溴单质;3. 脂肪:饱和脂肪酸甘油酯,常温固态,如猪油、牛油油;4. 皂化反应:油脂与碱反应生成甘油与高级脂肪酸钠;5. 油脂硬化:不饱和高级脂肪酸甘油酯与氢气反应生成饱和高级脂肪酸甘油酯8. 硬水中有较多的Mg2+、Ca2+,会生成不溶于水的(C17H35COO)2Mg和(C17H35COO)2Ca,使肥皂的消耗量增加,故不宜在硬水中使用肥皂;9. 不饱和脂肪酸甘油酯中的双键会被空气氧化而变质;
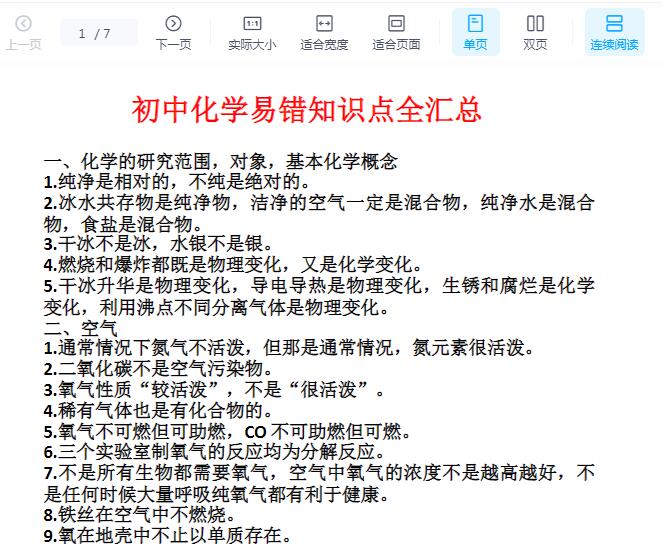
1. 原子核不一定都是由质子和中子构成的。如氢的同位素(11H)中只有一个质子。2. 酸性氧化物不一定都是非金属氧化物。如Mn2O7是HMnO4的酸酐,是金属氧化物。3. 非金属氧化物不一定都是酸性氧化物。如CO、NO都不能与碱反应,是不成盐氧化物。4. 金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物。5. 电离出的阳离子都是氢离子的不一定是酸。如苯酚电离出的阳离子都是氢离子,属酚类,不属于酸。6. 由同种元素组成的物质不一定是单质。如金刚石与石墨均由碳元素组成,二者混合所得的物质是混合物;由同种元素组成的纯净物是单质。7. 晶体中含有阳离子不一定含有阴离子。如金属晶体中含有金属阳离子和自由电子,而无阴离子。8. 有单质参加或生成的化学反应不一定是氧化还原反应。如金刚石→石墨,同素异形体间的转化因反应前后均为单质,元素的化合价没有变化,是非氧化还原反应。9. 离子化合物中不一定含有金属离子。如NH4Cl属于离子化合物,其中不含金属离子。10. 与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物。如NO2能与水反应生成酸—硝酸,但不是硝酸的酸酐,硝酸的酸酐是N2O5,Na2O2能与水反应生成碱—NaOH,但它不属于碱性氧化物,是过氧化物。11. pH=7的溶液不一定是中性溶液。只有在常温时水的离子积是1×10-14,此时pH=7的溶液才是中性。12. 用pH试纸测溶液的pH时,试纸用蒸馏水湿润,测得溶液的pH不一定有误差。13. 分子晶体中不一定含有共价键。如稀有气体在固态时均为分子晶体,不含共价键。14. 能使品红溶液褪色的气体不一定是SO2,如Cl2、O3均能使品红溶液褪色。15. 金属阳离子被还原不一定得到金属单质。如Fe3+可被还原为Fe2+。16. 某元素由化合态变为游离态时,该元素不一定被还原。如2H2O=2H2↑+O2↑,氢元素被还原而氧元素被氧化。17. 强氧化物与强还原剂不一定能发生氧化还原反应。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥氢气,因二者不发生反应。18. 放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生。如碳与氧气的反应为放热反应,但须点燃;Ba(OH)2·8H2O与NH4Cl反应为吸热反应,但在常温下很容易发生。19. 含金属元素的离子不一定都是阳离子。如AlO2-、MnO4-。20. 最外层电子数大于4的元素不一定是非金属元素。如周期表中ⅣA、ⅤA、ⅥA中的金属元素最外层电子数均多于4个。
21. 不能在强酸性溶液中大量存在的离子,不一定能在强碱性溶液中大量存在。如HCO3-、HS-等离子既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在。22. 组成和结构相似的物质,相对分子质量越大,熔沸点不一定越高。一般情况下该结论是正确的,但因H2O、HF、NH3等分子间能形成氢键,熔沸点均比同主族元素的氢化物高。23. 只由非金属元素组成的晶体不一定属于分子晶体。如NH4Cl属于离子晶体。24. 只含有极性键的分子不一定是极性分子。如CCl4、CO2等都是含有极性键的非极性分子。25. 铁与强氧化性酸反应不一定生成三价铁的化合物。铁与浓硫酸、硝酸等反应,若铁过量则生成亚铁离子。26. 强电解质不一定导电;一般强电解质的晶体不导电;27. 强电解质的导电性不一定强于弱电解质;与溶度有关;28. 失去电子难的原子获得电子的能力不一定强。如稀有气体原子既不易失去电子也不易得到电子。各位亲爱的读者,近期,gongzhong号改变了推送规则,请大家多点文末在看,或者星标升学的秘诀,否则很可能看不到我们的更新了哦~
设升学的秘诀为★星标★gongzhong号,天天阅读好资料!由于时间的关系,今天的学习内容老师就先和大家分享到这里,希望这篇文章能给孩子带来一些帮助。


点击文字即可阅读
高中生物:把6册生物书整理成9页纸,孩子吃透,3年成绩次次100!
高中英语必考3500词最全解析版!高一高二高三都需要!
老师整理资料不易,喜欢就帮忙点赞、分享吧!
求学之路,任重道远,让我们携手并进,一起努力!














![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)

![高中地理全知识点归纳:97个必背知识点,立即收藏![百度云资源]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230505ml3/100-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)











相关资源