【中考必备】初中化学之计算题专项训练,吃透多拿15分!
发布于 2021-04-11 13:15 ,所属分类:知识学习综合资讯
精品资料
初中化学知识点笔记整理归纳!
初中化学知识点总复习,全面又详细!
初三化学:20个常用实验器材一览,新学期必须掌握!
物理老师将初中2年考点,编成几百道填空题,背熟考试冲高分!
初中2年记住这15个“必考”实验,中考满分没问题
初中物理:200道核心填空题归纳!细致到章节,2年重点一目了然!
化学是同学们刚开始上初三就会接触到的学科,因为同学们只有一年的复习时间,而这一年又是准备中考最关键的时期,所以一定要抓紧时间学好化学,不要拿下基础知识。在中考化学当中,计算题占有很大的比例,并且也是重点和难点集合的题型。很多同学在计算题上面失分严重,这样的情况就需要同学们去坚持练习化学计算题。只有学会运用,才会熟练掌握。
现在,老师就跟同学们分享一份自己整理的中考化学计算题专题训练。里面涵盖了所有化学知识点,后面还附有完整答案,供同学们反复练习。这份训练针对性强,化学基础薄弱的同学可以打印下来,自己练习。家有中考学生的家长朋友们务必打印下来给孩子练习。

题型一:文字叙述型
1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量分数?
2.把7g含杂质的锌片(杂质不与硫酸反应)放在盛有100g足量的稀硫酸的烧杯里,反应停止后称得烧杯里物质的总质量为106.8g。
(1)计算反应后生成的氢气的质量;(2)计算不纯的锌片中单质锌的质量分数。
3、用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g固体物质,计算原混合物中二氧化锰的质量?
4、取34克过氧化氢溶液再加入0.5克二氧化锰后至质量不减小时,所得剩余物的质量33.7克。求:(1)根据质量守恒定律,反应生成氧气的质量为。
(2)计算该过氧化氢溶液中溶质的质量分数。
5.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。试计算:
(1)硫酸中氢、硫、氧元素的质量比为:_______________
(2)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?
(3)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?
题型二:图像呈上升趋势型
1.在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题:

(1)当滴加了73 g稀盐酸时,放出气体的总质量为___________g。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是___________。
(3)当滴加了73 g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
2.现取13.4g含氯化钙的氯化钠固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。

求:(1)当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是多少g。
(2)样品中氯化钠的质量是多少?
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
3.实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加
入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。请计算:

(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体___________g。
(2)BaCl2溶液的溶质质量分数是多少?
题型三:表格式
1.为了测定某铜锌合金的成分,某同学做了如下实验,实验中的数据如下
1 | 2 | 3 | |
所用合金的质量/g | 25 | 25 | 50 |
所用硫酸液的质量/g | 120 | 160 | 100 |
生成氢气的质量/g | 0.4 | 0.4 | 0.4 |
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为_______时,表明合金中的锌与稀硫酸中的硫酸恰好完全反应。
(2)试计算该合金中锌的质量分数。
2、为了测定某黄铜{铜和锌的合金}样品中锌的质量分数,现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:试求:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 5 | 5 | 5 |
生成氢气的质量(g) | 0.04 | m | 0.02 |
(1)m= 。
(2)此黄铜样品中锌的质量分数是多少?
3、为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
(1)上述反应的化学方程式为____________ ;
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式____________ ;
(3)所用稀盐酸中溶质的质量分数为________;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为________;
(5)黄铜样品中铜的质量分数为________________。
4、实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
1 | 2 | 3 | 4 | |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(1)上表中X的数值为_________;
(2)计算原固体混合物样品中氯化镁的质量分数是多少?
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入多少克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
5、某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 剩余固体质量 |
第一次加入10g | mg |
第二次加入10g | 2.0g |
第三次加入10g | 1.5g |
第四次加入10g | 1.0g |
第五次加入10g | 0.6g |
第六次加入10g | 0.6g |
(1)测定过程中发生反应的化学方程式为;
(2)从以上数据可知,最后剩余的0.6g固体的成分是;这六次实验中,第次加入稀硫酸时样品中的镁已经完全反应;表格中,m=。
(3)计算合金样品中镁的质量分数。
(4)计算所用稀硫酸中H2SO4的质量分数。
6、某学校的学习小组对当地的石灰石矿区进行调查,欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
实验次数 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 20 | 11 |
2 | 20 | 6 |
3 | 20 | 2.8 |
4 | 20 | n |
(1)表中 n的数值为。
(2)样品中碳酸钙的质量分数是。
(3)求盐酸中溶质的质量分数。

往期精彩
微课 |中考物理一轮复习重难点讲解合辑
微课合辑 | 中考数学一轮复习专题讲解
【八年级物理】第一次月考试卷1(附详细解析)
【八年级物理】9月月考试卷2(附详细解析)
人教版:九年级上册物理第一次月考试卷(1)
九年级上学期化学第一次月考试卷(1)
九年级上学期化学第一次月考试卷(2)
九年级上册化学第一次月考复习重点知识清单
初中化学:第一次月考知识总结(默写版)
33个精彩的化学原理动图, 加详细的原理分析
初中物理“思维导图”各章节全汇总!涵盖全年知识点!
初中化学思维导图全汇总!学习重点都在这里!
初中3年物理必考“实验”总结,全部都在这里!
初中化学丨酸、碱、盐化学高频考点汇总,再涨20分!





















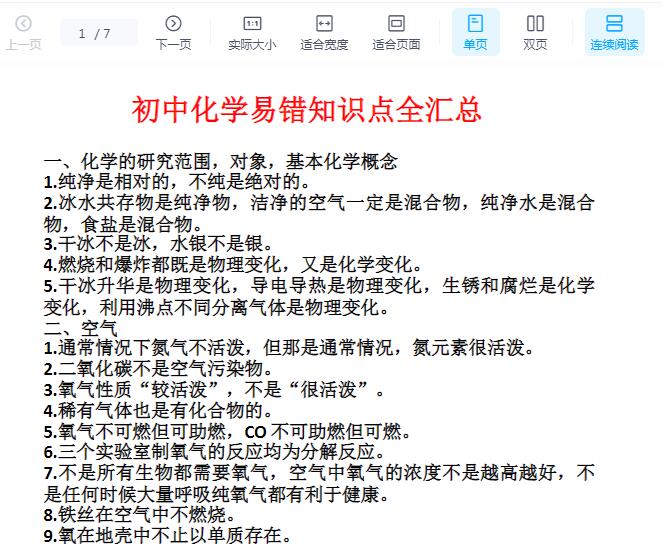

相关资源