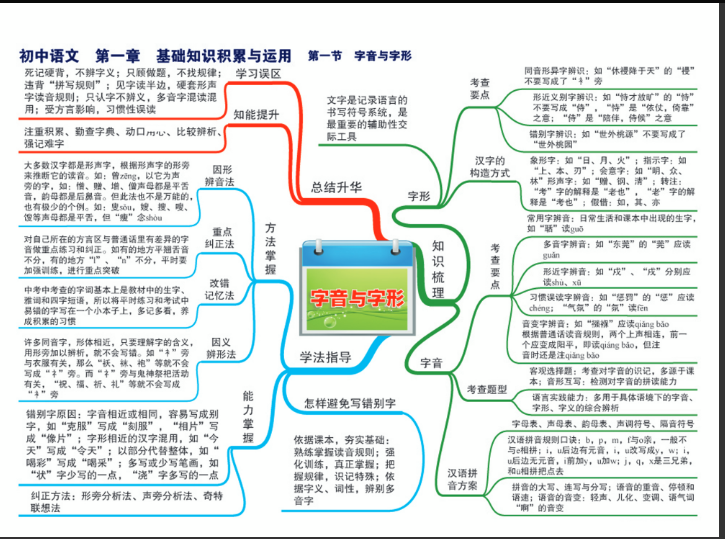
实验思维——解决化学疑难问题的一种重要思维
发布于 2021-04-01 01:45 ,所属分类:知识学习综合资讯
有些问题,不是从解决问题到形成思维,而是从形成思维到解决问题。
实验思维解决问题的思维模式是:
(1)方程式:写出对应的反应方程式。
(2)操作:把自己当做完成这个过程的操作者(实验者),操作和控制这个反应过程。并分析这个过程中物质的变化。
(3)分析:利用过程去分析对应的问题中的数据与过程之间的关联。结合知识分析数据的变化、特殊点对应的含义。
(4)求解:进行推理和计算解决问题。
这种方法的优点是能很明白地解决问题。
例一、化学平衡
肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g)⇌MbO2(aq),该反应的平衡常数可表示为K=c(MbO2)/[c(Mb)·p(O2)]。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示,α=[c(MbO2)/c初始(Mb)]×100%。试求出图中c点时,上述反应的平衡常数K=______。

分析:
(1)方程式:
反应方程式为Mb(aq)+O2(g)⇌MbO2(aq)。
(2)操作:
增大O2压强,会增加O2的浓度,平衡正向移动,Mb的转化率会提高,生成的MbO2的浓度提高,剩余的Mb的浓度会降低。
(3)分析:
坐标图中,横坐标向右表示O2的压强增大,与实际操作中的增压过程对应。
纵坐标向上表示与c(MbO2)/c初始(Mb)正相关的数据,随着增压,平衡正向移动,数据变大。
(4)求解:
根据c点,c(MbO2)=0.9c初始(Mb),求得c平衡(Mb)=0.1c初始(Mb),又p(O2)=4.5kPa,则
K=c(MbO2)/[c(Mb)·p(O2)]
=0.9c初始(Mb)/[0.1c初始(Mb)×4.5kPa]
=2 kPa-1
例二、溶液平衡
常温下,向20.00 mL 0.1mol·L-1HA溶液中滴入0.1 mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lg c(H+)水]与所加NaOH溶液体积的关系如图所示。回答下列问题:
①0.1 mol·L-1HA溶液的pH=________。
②M点的溶质为_______,溶液显_____性。
③N点的溶质为_______,溶液显_____性。
④P点的溶质为______,溶液显_____性。

分析:
(1)方程式:
反应方程式为HA+NaOH=NaA+H2O。
(2)操作:
向HA溶液中滴入NaOH溶液后,溶液变为HA和NaA的混合液,HA慢慢减少,NaA慢慢增加。
至完全生成NaA。
然后,溶液变为NaA和NaOH的混合液,且NaOH慢慢增加。
(3)分析:
坐标图中,横坐标向右表示加入NaOH溶液的体积慢慢增加,与实际操作过程一致。
纵坐标表示,水电离出的c(H+)水的负对数。利用知识:水电离出的c(H+)水的大小与溶液中的酸、碱、水解盐有关。
只有酸时,水电离出的c(H+)水<10-7。负对数值>7。只有水解盐时,水电离出的c(H+)水>10-7。负对数值<7。只有碱时,水电离出的c(H+)水<10-7。负对数值>7。
随着横坐标的向右变化,溶液由酸很多,到只有水解盐,到碱很多,水电离出的c(H+)水的负对数由大于7到小于7再到大于7,与图像的变化对应。
N点为只有NaA时的溶液,M点为HA与NaA的混合液,P点为NaA与NaOH的混合液。
(4)求解:
①0.1 mol·L-1HA溶液是指加入NaOH溶液之前。水电离出的c(H+)水为10-11mol·L-1,则酸电离出的c(H+)为10-3mol·L-1,则pH=3。
②P点为NaA与NaOH的混合液:NaA水解显碱性,NaOH电离显碱性,溶液肯定显碱性。
③N点为只有NaA时的溶液:水解后显碱性。
④M点为HA与NaA的混合液:HA电离显酸性,NaA水解显碱性。若水电离出的c(H+)水为10-7mol·L-1,说明既不发生HA的电离,也不发生NaA的水解,溶液显中性。
例三:实验
在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为____________mol·L-1,此时溶液中c(CrO42-)等于____________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
分析:
(1)反应方程式为:开始滴定后发生Ag++Cl-=AgCl,达到反应终点时发生2Ag++CrO42-= Ag2CrO4。
(2)操作:向含Cl-的溶液逐渐滴入AgNO3溶液,生成AgCl沉淀,溶液中的Cl-浓度慢慢降低,Ag+浓度慢慢升高。
当达到滴定终点时,Ag+浓度达到与CrO42-反应的可能,与其反应生成Ag2CrO4沉淀,沉淀出现颜色变化。实验者判断达到反应终点,停止滴定实验。
(3)分析:利用Cl-恰好完全沉淀,浓度等于1.0×10-5mol·L-1,求出Ag+浓度已经达到的浓度。再根据此时Ag2CrO4沉淀已经开始生成。利用Ksp(Ag2CrO4)求出CrO42-的浓度。
(4)求解:
根据Ksp(AgCl)=c(Ag+)·c(Cl-)=2.0×10-10,c(Cl-)=1.0×10-5mol·L-1),
求得c(Ag+)=2.0×10-5mol·L-1。
再根据Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=2.0×10-12,
求得c(CrO42-)=5.0×10-3mol·L-1。
例四:计算
在1.0 L Na2CO3溶液中溶解0.01 mol BaSO4,列式计算,Na2CO3溶液的最初浓度不得低于 mol·L-1(忽略溶液体积变化)。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9]
分析:
(1)反应方程式为:Na2CO3(aq)+BaSO4(s)⇌Na2SO4(aq)+BaCO3(s)。
(2)操作:将BaSO4固体与1.0 LNa2CO3溶液混合,BaSO4固体发生沉淀转化,逐渐与Na2CO3溶液发生反应生成BaCO3固体,同时生成Na2SO4形成溶液。
当BaSO4溶解掉0.01mol时,溶解停止,形成反应平衡。
(3)分析:当BaSO4固体溶解掉0.01mol时,Na2CO3消耗0.01mol,浓度减小0.01mol·L-1。生成BaCO3固体0.01mol,生成Na2SO40.01mol,Na2SO4的浓度为0.01mol·L-1。溶液中存在BaSO4固体的沉淀溶解平衡和BaCO3固体的沉淀溶解平衡。
(4)求解:
设初始的c(CO32-)为x mol·L-1。
根据Ksp(BaCO3)=c(Ba2+)·c(CO32-)=5.1×10-9,
求得c(Ba2+)×(x-0.01)=5.1×10-9………………①
根据Ksp(BaSO4)=c(Ba2+)·c(SO42-)=1.1×10-10,
求得c(Ba2+)×0.01=1.1×10-10………………②
联立①②,解得x=0.46
更多内容:
请关注公众号:高中化学教学研究






![[php基础] 解决PHP中的Bug,搞定PHP的错误体系的各种问题](https://static.kouhao8.com/sucaidashi/xkbb/fd5a6305469616cdc05c47fa0e881d00.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)


















相关资源