中考前,所有学霸都看了这份【初中化学易错易混知识点总结】!
发布于 2022-06-12 13:10 ,所属分类:在线教育信息快讯
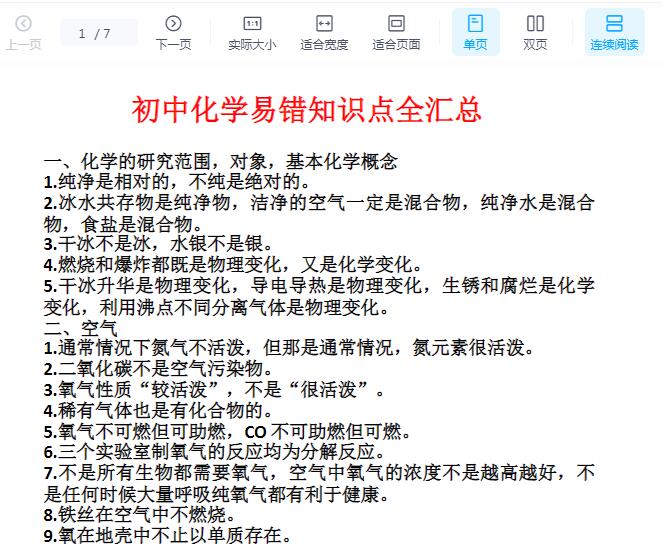
一、化学的研究范围,对象,基本化学概念

1.纯净物是相对的,绝对纯净的物质是没有的。
2.冰水“混合”物是纯净物,洁净的空气一定是混合物,市售“纯净水”是混合物,食盐主要成分是氯化钠,属于混合物。
3.干冰不是冰,水银不是银,纯碱不是碱,铅笔不含铅,刷暖气片的“银粉”是铝粉。
4.燃烧是化学变化,爆炸可以是化学变化(如火药爆炸、瓦斯爆炸),也可以是物理变化(如气球和轮胎爆炸)。
5.蒸馏是物理变化,干馏是化学变化,利用沸点分离空气和石油是物理变化,硬水中加肥皂水出浮渣是化学变化。
6.氧化物中一定含有氧元素,含有氧元素的化合物不一定就是氧化物(如KClO3)。


三、水

1.一种元素可以组成混合物(如O2和O3混合),但一定不可以组成化合物。
2.天然水都是混合物,新制的蒸馏水是纯净物,硬水一定是混合物。
3.汽化时分子体积不变,分子间隔变大。
4.大部分物质熔化体积变大,但水例外,冰熔化体积减小。
5.电解水时,负氢正氧,体积比2:1 (分子个数比哦)

四、原子的组成、元素、化学式

1.中子数不一定等于质子数,有的原子没有中子,氢原子中子数可以为0。
2.相对原子量没有单位,是一个比值。
3.氧化铁是三氧化二铁,不是FeO
4.CO2、SO2、H2O2中都不含有O2分子
5.食品的标签中标有X(元素符号)的含量,这个X指的是元素而不是单质。
6.氧在化合物中通常为-2价,但过氧化氢中氧是-1价。
7.海水中最多的元素是氧,空气中最多的元素是氮,地壳中最多的元素是氧。

五、质量守恒定律

1.无论反应后固体质量增加或减少,这个反应都遵循质量守恒定律。
2.化学变化中,元素和原子种类不变,但物质和分子的种类一定改变。
3.化学方程式中,反应前有气体,生成物气体不写“↑”,反应生成的水蒸气不写“↑”。
4.某物质在氧气中充分燃烧生成二氧化碳和水,只能证明其中有碳元素和氢元素,不能证明其中有氧元素。

六、碳及其氧化物

1.金刚石和石墨都是碳的单质,但石墨和金刚石不是同种物质,石墨转化为金刚石是化学变化。
2.木炭和活性炭不属于单质,但主要成分是碳。
3.碳单质只在“常温”下化学性质稳定。例如:钻石恒久远,一颗永流传。
4.紫色石蕊通入二氧化碳后变红,使紫色石蕊变红的是碳酸,而不是二氧化碳。
5.金刚石和石墨物理性质不同是“碳原子排列方式不同”。二氧化碳和一氧化碳的化学性质不同是因为二者的分子不同。生铁和钢的性能不同是含碳量不同。
6.实验室制二氧化碳用的药品是大理石或石灰石与稀盐酸,不是CaCO3和HCl,也不能用稀硫酸。
7.长颈漏斗脖子长不戴帽子,分液漏斗脖子短、戴帽子、还打领结(阀门)。

七、燃烧与燃料

1.广义的燃烧条件必须有氧气,但燃烧不一定有氧气参加。二氧化碳不能扑灭燃烧的钠、镁,因为这些活泼金属在二氧化碳中也能燃烧。
2.灭火的一条措施不是降低着火点,而是把可燃物的温度降低至着火点以下。
3.煤、石油、天然气是三大化石燃料,化石燃料还有可燃冰,油页岩等等。
4.缓慢氧化是放热的,尽管有些你察觉不到。缓慢氧化不一定能达到着火点。

八、金属材料

1.合金中可以有非金属;钢不是纯的铁,是含碳量较少的铁合金。
2.纯铁的性能不如生铁,纯铁硬度小不适于做金属制品。
3.浓硫酸、硝酸不能置换金属中的氢。
4.金属与酸反应速度不能作为金属活动性的绝对依据,金属之间的置换关系可判断金属的活动性。
5.铝和金都不易锈蚀,铝是因为表面形成了致密的氧化膜;金是不易与空气中成分发生反应。
6.铁在置换反应中永远只生成二价铁!!!

九、溶液

1.碘酒中的溶剂是酒精,不是酒。75%的酒精溶液中,溶剂是水。
2.溶液均一稳定的混合物,均一稳定的不一定是溶液。牛奶不是溶液,因为许多物质以颗粒形式存在,而不是分子或离子形式。
3.饱和与不饱和溶液与浓稀溶液不直接相关,例如饱和氢氧化钙溶液浓度可能不到0.1%。
4.硫酸铜溶液中的溶质是硫酸铜,溶剂是水。而不是什么铜和硫酸。
5.溶解度是个带单位(g)的数,是100g水中溶解的质量。
6.溶液的浓度是溶质与溶液质量的比,不是溶质/溶剂。
7.汽油和酒精除油污是因为汽油能溶解油污,洗洁精除油污是乳化油污,氢氧化钠或碳酸钠除油污是与油污发生了反应。

8.甲从溶液析出易采用冷却热饱和溶液/降温结晶的方法;乙从溶液析出易采用蒸发溶剂或蒸发结晶的方法。

十、酸碱盐

1.pH为0的溶液是酸性溶液,且酸性较强。
2.盐和碱中不一定含有金属离子,如NH4Cl、NH3·H2O。
3.中和反应是酸和碱的反应,生成盐和水的反应不一定是中和反应。
4.二氧化碳和氢氧化钠反应不是复分解反应。这是二氧化碳和水先发生化合反应,碳酸又与氢氧化钠发生复分解反应中的中和反应。
5.酸碱度指的是溶液的酸碱性的强弱,pH试纸测量的是酸碱度,指示剂显示的是酸碱性。
6.稀释浓硫酸不可以将水倒入硫酸中,应将酸入水,沿容器壁缓缓倒下,同时不断搅拌,不可以用量筒稀释浓硫酸。
7.浓盐酸在空气中生成白雾,是因为浓盐酸有极强的挥发性,挥发的氯化氢气体与水蒸气结合成盐酸小液滴。
8.电离不是通电分离,而是在水分子作用下解离出离子。酸碱盐溶液能导电,是水溶液中有自由移动的离子。
9.只有少部分盐溶液是呈中性的。

十一、化学与生活

1.钙不是微量元素,是常量元素。
2.缺碘和碘过量均会引起甲状腺肿大。
3.糖类物质不一定有甜味,有甜味的不一定是糖类物质。
4.油脂不是脂肪,油脂分两种,液体的叫做油,固体叫做脂。
5.加碘盐中加入的不是单质碘(碘单质有毒),而是碘酸钾。
▎版权:本文来源于名校教研 化学,版权归相关权利人所有,如有侵权请联系我们。




![高考地理40个易混易错点必纠![百度云资源]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230505ml3/6-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)
![高中地理常考易错易混点汇总(附丰收节专题)![百度云资源]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230505ml3/5-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)






![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)
相关资源