咨询内容:老师您好,想咨询一下:申办方委托药学研究公司进行药学研究,向其赠送原料、辅料、包材用于研究,对于受托的药学研究公司,其是否需要留存原辅包的所有资质证明文件,包括合同、发票、批准证明文件等(复印件),还是有相应的赠送证明即可,研制现场核查时核查老师是如何要求的,望老师给予指导,谢谢!回复:您好,您提及的这些这些证明文件都应当保留,特别是证明关键批次样品试制所用的原辅料、直接接触药品的包装材料和容器等具有合法来源的(如供货协议、发票等),并与申报资料一致。研制现场核查时,企业应能提供以追溯。咨询内容:无菌药品附录中提到,应当对微生物进行动态监测,监测方法包括:沉降菌法、定量空气浮游菌采样法、表面取样法(如棉签擦拭法和接触碟法)等,日常生产中对于C+A下,无菌隔离器的表面微生物的取样可不可以只用接触碟法、不用棉签擦拭法?回复:您好!表面微生物的检测方法必须考虑取样的准确性和代表性,基本的监测方法有接触碟法、擦拭法以及表面冲洗法,取样的准确性受收集和处理样品的过程影响。各种取样方法均有优缺点,至于具体采用何种取样法,应根据企业的实际情况综合评估确定。感谢您对我中心的关注!咨询内容:老师,您好!药品长期稳定性考察的测试时间点中国药典有规定,但药品持续稳定性考察的时间测试点没有规定,我们一个药品有效期为24个月,是否可以设置为有效期的开始点(0个月)、中间点(12个月)和结束点(24个月)?或者还有其它更好的建议?谢谢!回复:您好!《药品生产质量管理规范》第二百三十五条规定,考察批次和检验频次应当能够获得足够的数据,以供趋势分析。通常情况下,每种规格、每种内包装形式的药品,至少每年应当考察一个批次,除非当年没有生产。3个考察时间点是不能接受的,不满足趋势分析的需要。谢谢您对我中心的关注!咨询内容:老师,你好,我司有个化学原料药,在粗品阶段是固体,且在各种溶剂中均不溶。一般原料药在最后一步精制过程中,是通过管道过滤进入洁净区,以去除异物和降低微生物负荷。像这种固体且不溶的物料怎么进入洁净区?怎么操作符合GMP要求?若必须通过管道过滤进入,我司该该品种在粗品前一步是可溶性的,可以把这个步骤一起放入洁净区,但由于该步骤反应温度有60-70℃,而洁净区对温湿度有要求,这对洁净区也是个挑战。回复:您好!由于对您咨询的品种的生产工艺、质量标准等未知,故不能给出确切的建议。一般情况下,物料、产品进入洁净区的方式为管道输送或传递窗、传递间等传递。对于在洁净区的生产工序有哪些,应根据产品特性、质量标准、设备设施等综合考虑。感谢您对我中心的关注!5、标题:大容量注射剂热穿透试验容器内部冷热点确认
咨询内容:老师您好!有两个问题咨询:(1)对于软袋包装的100ml、250ml和500ml大容量注射剂,采用顶部和侧面喷淋方式的水浴灭菌柜灭菌,被灭菌的药物平放在灭菌车上,袋身整体高度不超过5cm,请问在做热穿透试验时,是否要对软袋内部不同位置冷热点进行确认?(2)对100ml规格的塑瓶和直立袋在做热穿透试验时,是否要对容器内部不同位置冷热点进行确认?回复:您好!热穿透确认是证明预期的能量已经传递到材料(比如液体)或负荷内的元件的表面。热穿透温度探测器应位于液体容器的冷点位置或最难灭菌的多孔/硬元件的最慢加热位置。容器内的冷点是灭菌过程中灌封液体容器中最低F0的部位,在液体物品灭菌程序的开发时,采用冷点建立灭菌程序的方法是一个比较保守的方法。对于大容量注射剂而言,冷点位于产品的几何中心和纵轴的底部,此冷点需要确认。感谢您对我中心的关注!6、标题:做普通口服固体制剂中间产品和待包装产品的暂存期制定依据的稳定性考察
咨询内容:请问:做普通口服固体制剂中间产品和待包装产品的暂存期制定依据的稳定性考察实验,是需要整批产品在暂存间(或中间站)进行存储条件下的稳定性考察?还是可以取本批产品的小样,放稳定性试验箱内进行暂存条件下的稳定性考察?问题核心为:中间产品和待包装产品的暂存期制定依据的稳定性考察对象是需要整批产品进行考察还是可以取小样进行考察?谢谢老师的回答,辛苦回复:您好!中间产品和待包装产品(以下简称产品)进行稳定性考察时,①产品应在相应的环境条件下储存(模拟最恶劣的贮存条件,可用恒温恒湿箱或真实的贮存条件);②产品数量足够且应具有代表性;③产品的包装容器应与商业化生产产品相同或相似。感谢您对我中心的关注!7、标题:液相 chemstation C版本工作站在现场核查时的合规性考虑。
咨询内容:老师您好:我们有一个化学原料药品种,工艺优化部分的HPLC图谱是在chemstation C版本的工作站分析的,我们的研发工作严格遵守真实性要求,请问由于该版本工作站系统本身的缺陷,现场核查的时候是否能接受?回复:您好!在药品研发过程中,应当采取相应的措施确保数据可靠性。如果系统本身存在缺陷,应当立即评估并改正,以确保数据可靠性。8、标题:关于滴眼液内包材变更
咨询内容:我司有一滴眼液产品拟进行内包材变更粒料。我司使用的是吹灌封工艺。请问变更粒料会引发原辅包关联审评现场检查吗?回复:您好!根据总局关于调整药品注册受理工作的公告(2017年第134号),根据药品技术审评中的需求开展现场核查 , 建议您咨询审评中心。9、标题:新药/仿制药在批准前BE批、稳定性批次、注册批可否销毁
咨询内容:请问,新药/仿制药在批准前BE批、稳定性批次、注册批可否销毁?其他中试以上研究批次可否销毁?是否有文件规定了相关要求。回复:您好!品种注册申报过程中的关键生产批次建议在品种审批结束前不要销毁,以免影响品种相关补充研究或者现场核查、抽样检验等。10、标题:实验记录、使用记录等操作者签字规范性问题咨询
咨询内容:老师,您好!实验记录与使用记录,操作者使用名字首字母缩写进行签字(例如:李强,签字:LQ),但签名字迹已在质量部与人力资源部备案,请问现场核查时是否可以接受?如不能,应采取何种补救措施?敬盼您的回复,谢谢!回复:您好!签字应当能使相关的活动或数据归属至人,保证相关记录内容真实、可追溯。11、标题:肌肉松弛药品是否不能跟普通药品共线生产
咨询内容:您好,我公司拟开发一化药品种,舒更葡糖钠注射液,属于肌肉松弛类药品。我们关注到同品种申报企业有按照特殊药品安排该品种样品的生产工艺验证,与普通药品生产线区分开来。GMP中未明确上述事项,特此提出,肌肉松弛药品是否不能跟普通药品共线生产?请老师抽出宝贵时间予以指导,十分感谢。回复:您好!企业应当根据药品的特性、工艺和预定用途等因素进行综合评估,确定共用设施设备的可行性,并制定相应的控制措施及验证方式。12、标题:是否需要专线生产
咨询内容:老师您好!请教,氟维司群注射液——雌激素作用的有效和特异性抑制剂,是否需要专线生产?回复:您好!企业应当根据药品的特性、工艺和预定用途等因素进行综合评估,确定共用设施设备的可行性,并制定相应的控制措施及验证方式。13、标题:关于注册申报时工艺验证批次的检验问题
咨询内容:老师: 您好 请问原料药注册申报的工艺验证期间,生产企业是否可以将中间体检验以及成品检验的所有项目均委托其他单位检测?工艺验证批次的稳定性研究也委托其他单位考察?现场检查是否会被接受?回复:您好!申请人应当具有质量控制能力,质量控制实验室的人员、设施、设备应当与产品性质和生产规模相适应。企业通常不得进行委托检验,确需委托检验的,应当按照药品GMP第十一章中委托检验部分的规定,委托外部实验室进行检验,但应当在检验报告中予以说明,并在申报资料中明确说明。14、标题:药品GMP认证
咨询内容:新的药品管理法于今年12月1日实施,那么,在12月1日前(含11月30日)药品GMP证书到期的企业是否需要进行药品GMP再认证?请老师在百忙中给予回复为盼,谢谢!回复:您好!新修订的《药品管理法》自2019年12月1日起施行,请关注相关法规、规章及国家局的规范性文件等内容,以正式发布的文件为准。15、标题:GMP认证
咨询内容:老师您好!新的《药品管理法》于今日上午表决通过,定在2019年12月1日实施,对于GMP认证这块,企业还需要申报GMP认证吗?例如我司现在有一新药拿到了药品注册批件,准备近期申报GMP认证。时间刚好在2019年12月-2020年1月左右。我司现在是继续申请GMP认证,还是自行确认符合GMP要求直接生产?回复:您好!新修订的《药品管理法》自2019年12月1日起施行,请关注相关法规、规章及国家局的规范性文件等内容,以正式发布的文件为准。16、标题:原辅包和制剂关联审评政策下,原料药的销售问题。
咨询内容:老师您好:请问,原辅包和制剂关联审评政策下,原料药企业新开发的原料药产品是否可销售给仿制药企业用于制剂研发?对于进口未获得批准文件的原料药用于制剂研发的操作,是有文件《国家食品药品监督管理总局关于研制过程中所需研究用对照药品一次性进口有关事宜的公告(2016年第120号)》支持的。但对于国产未获批准文件的原料药用于制剂研发,有哪个文件支持呢?谢谢解答。回复:您好!建议向药品注册管理部门咨询。感谢您对我中心的关注!17、标题:生物相容性检测
咨询内容:请问需要灭菌的产品的生物相容性评价是使用未灭菌的产品还是灭菌的产品进行?还是都可以?回复:生物相容性评价为产品注册过程中开展,请咨询国家药监局医疗器械技术审 评中心。18、标题:参比制剂发票问题咨询
咨询内容:我们选择的参比制剂在国外上市,用于药学质量对比研究的参比制剂没有进行一次性进口,是在国外直接采购的,发票为药店购物票(等同于上市国家的发票),这种情况,提供国外发票是否能证明参比制剂的来源是有效的。回复:您好!根据《总局关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等4个指导原则的通告》(2017年第77号)附件1仿制药质量和疗效一致性评价研制现场核查指导原则,现场检查确认研究用参比制剂需要有明确的来源及来源证明,如购买发票、赠送证明等。申请人应将参比制剂的来源证明保存完整备查。19、标题:通过一致性评价的品种需进行原辅料供应商变更
咨询内容:老师您好!我想咨询一下:通过一致性评价的品种如果需进行原辅料供应商的变更,企业需采取哪些变更控制措施?目前有无相应的法规政策或指导原则指导企业开展相应的变更控制工作?盼复,谢谢!回复:您好!药品GMP对变更控制有明确的要求,药品生产企业应当按照药品GMP执行。企业应当建立变更控制系统,对所有影响产品质量的变更进行评估和管理。需要经药品监督管理部门批准的变更应当在得到批准后方可实施。另外,为规范和指导已上市化学药品的生产工艺变更研究,原食药监总局2017年发布了《已上市化学药品生产工艺变更研究技术指导原则》,该原则中未涉及的变更事项,仍按照2008年《已上市化学药品变更研究的技术指导原则(一)》开展变更研究。 


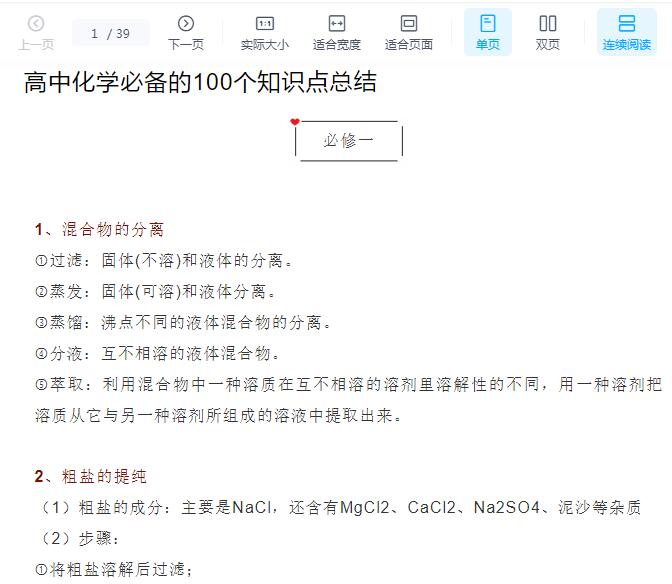
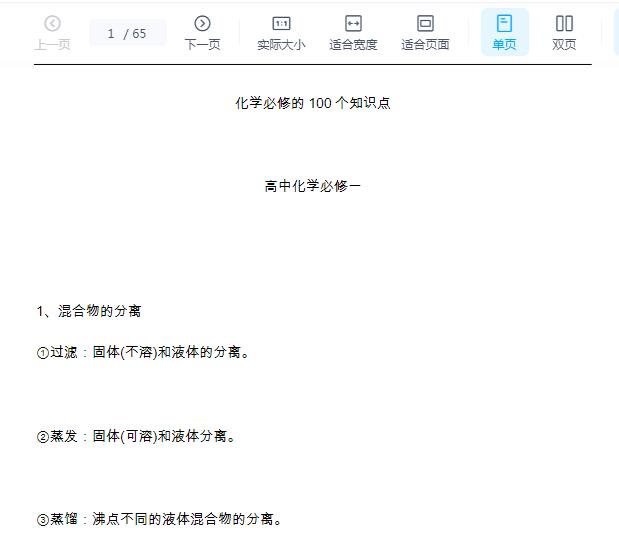

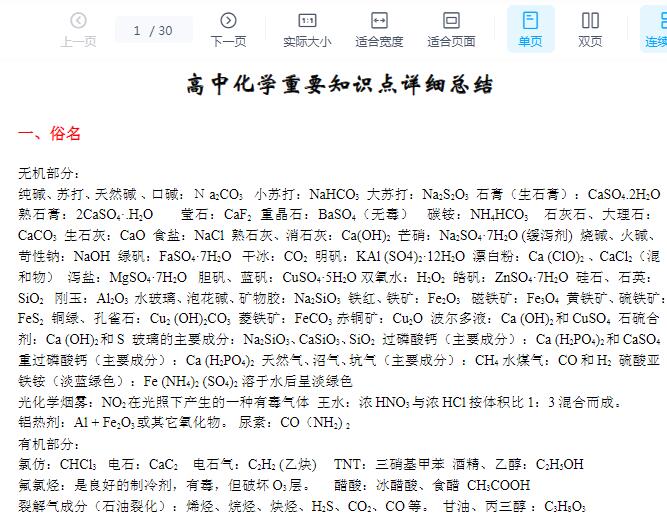
![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)


![高中语文数学英语物理化学生物政治历史地理精选干货40+[百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/101-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)







![[项目实战] 马震宇出品360问答系统项目实战 基于HDPHP框架](https://static.kouhao8.com/sucaidashi/xkbb/f4240cce2576c29c67fa506be08f5a39.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)



相关资源