高中化学十字交叉法计算方法总结
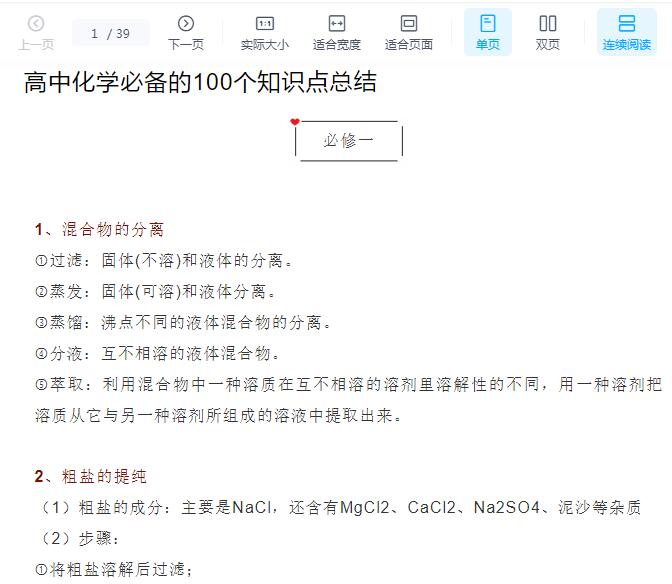
发布于 2021-04-02 03:28 ,所属分类:知识学习综合资讯


十字交叉法计算的式子如下:
十字交叉法巧解
一.有关质量分数的计算
1.设取用98%的浓硫酸X g,取用15%的稀硫酸Y g。
根据溶质质量守恒可得:98%X+15%Y=59%(X+Y),X和Y之比是溶液质量之比。
由十字交叉法可得:X/Y=44/39;再换算成体积比为:44/1.84:39/1.1=2/3。
2.M(C6H6)=78,其中碳质量分数为:C%=72/78=92.3%;
M(C6H6O)=94,其中碳的质量分数为:C%=72/94=76.6%。
依据碳元素质量守恒和十字交叉法可得混合物中苯酚的质量分数,再进一步求出氧的质量分数。
m(C6H6O)/m(C6H6)=2.3/13.4;O%=(2.3×16/92)/(2.3+13.4)=2.5%。(O%=1-90%×13/12)
二.有关平均相对分子质量的计算
3.M=2×9.7=19.4 > 17,说明混有空气;
根据质量守恒和十字交叉法可得:n(NH3)/n(空气)=9.6/2.4=4/1;
所以烧瓶内含NH3体积为4/5 L;空气不溶于水,当喷泉停止后,则烧瓶内的溶液为4/5 L。
4.74x+197y=100(x+y),由十字交叉法可得:x/y=97/26;
所以质量比为:m(Li2CO3)/m(BaCO3)=(97×74)/(26×197)=7/5。
三.有关平均相对原子质量的计算
5.n(B2H6)=5.6/22.4=0.25 mol,n(B)=0.25×2=0.5 mol;
M(B)=5.4/0.5=10.8 g/mol,n(10B)/n(11B)=0.2/0.8=1/4。
6.n(NaCl)=29.25/58.5=0.5 mol,n(37Cl)/n(35Cl)=0.5/1.5=1/3;
m(37Cl)=0.5×1/4×37=4.625 g。
四.有关平均分子式的计算
7.由C和H的原子守恒以及十字交叉法可得平均分子式为M=C2.5H7;
V(CH4)/V(C3H8)=1/3,V(C2H6)/V(C4H10)=3/1。
8.(1)由C原子守恒和十字交叉法可得平均分子式为M=C2.5Hy;依据题意有如下结果:
V(CH4)/V(C3H6)=1/3,V(CH4)/V(C4H8)=1/1,V(C2H6)/V(C3H6)=1/1,V(C2H6)/V(C4H8)=3/1。
(2)y=6.5,得平均分子式为M=C2.5H6.5;依据题意有如下结果:A是C2H6,B是C4H8。
五.有关反应热的计算
9.已知:Q氢气=571.6/2=285.8 kJ/mol,Q混合=3847/5=769.4 kJ/mol,Q丙烷=2220 kJ/mol;
由十字交叉法可得:V氢气/V丙烷=Q氢气/Q丙烷=1450.6/483.6=3/1。
六.有关混合物反应的计算
10.若皆为NaCl可得沉淀1.227 g,若皆为NaBr可得沉淀0.913 g;
由十字交叉法可得:mNaCl/mNaBr=0.187/0.127,故NaCl%=0.187/(0.187+0.127)=60%。
11.生成1 mol P4O10耗氧5 mol,生成1 mol P4O6耗氧3 mol,n(O2)=50.4/22.4=2.25 mol;
5x+3y=4.5(x+y),由十字交叉法可得:x/y=1.5/0.5=3/1。
七.巧练
12.n(CO2)=22.4/22.4=1 mol,由十字交叉法可得:n(Na2CO3)/n(NaHCO3)=16/6=8/3;
Na2CO3%=8×106/(8×106+3×84)=77.1%。
13.M=18.5,由十字交叉法可得:n(H2O)/n(D2O)=1.5/0.5=3/1,则n(D)/n(H)=3/1。
14.混合气体每mL耗O2 y/x mL,乙烯每mL耗O2 3 mL,乙炔每mL耗O2 2.5 mL;
由十字交叉法可得:n(C2H4)/n(C2H2)=V(C2H4)/V(C2H2)=(y/x-2.5)/(3-y/x)=(2y-5x)/(6x-2y).
15.M=24,则必有CH4,由十字交叉法可得:n(CH4)/n(C2nH2n)=(14n-24)/8;
x=8/(14n-24+8)=4/(7n-8),则n=(4/x+8)/7=4(1+2x)/7x。


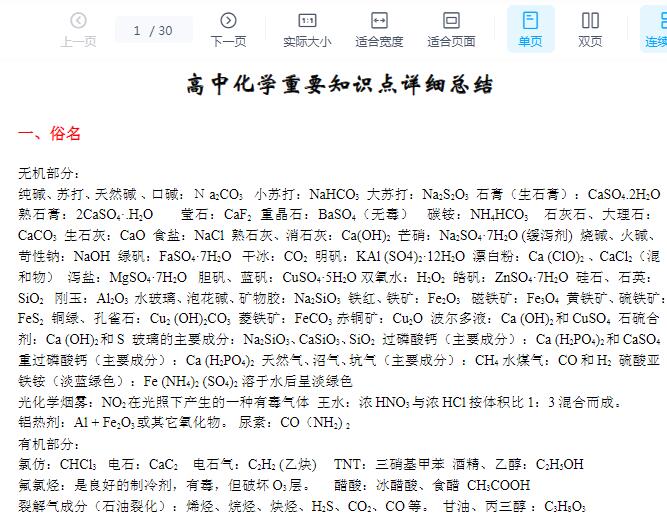

![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)







相关资源