2015年广东省深圳市中考化学真题及答案(WORD文档)
发布于 2021-09-02 15:11 ,所属分类:广东中考真题试卷及答案大全
2015年广东省深圳市中考化学真题及答案
一、选择题(共10小题,每小题3分,满分30分)
1.(3分)以下是生活常见现象或结论,正确的是( )
A.为了加强农作物产量,要尽可能多的使用农药
B.工业排污水会造成水体污染
C.在室内放盆水能防止CO中毒
D.塑料是有机合成材料,不能把它投进带有 标志的垃圾桶
标志的垃圾桶
2.(3分)下列化学用语正确的是( )
A.2H2O:2个水分子 B.SO4:硫酸根离子
C.N2:2个氮原子 D.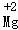 :镁离子
:镁离子
3.(3分)下列实验操作基本正确的是( )
A.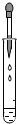 B.
B.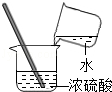 C.
C.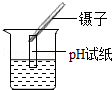 D.
D.
4.(3分)下列说法正确的是( )
A.用水区分氯化铁,氯化钠,硝酸钾三种晶体
B.无色透明的液体都为溶液
C.品红在水中扩散,说明分子在不断运动
D.海水晒盐是化学变化
5.(3分)下列说法错误的是( )
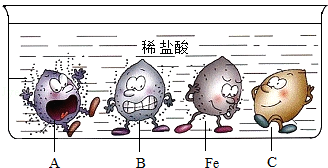
A.C可能是铜
B.将Fe放在B的盐溶液中可以置换出B
C.四种金属的活动性顺序是:A>B>Fe>C
D.钢和生铁都是铁合金
6.(3分)某反应的微观示意图如下,下列说法正确的是( )
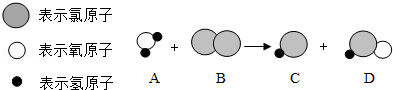
A.该反应说明原子在化学反应中可再分
B.反应物的分子个数比为3:2
C.所有参与反应的物质都是化合物
D.D物质中氯元素的化合价+1
7.(3分)如图为M,N两种物质(不含结晶水)的溶解度曲线图,下列说法正确的是( )
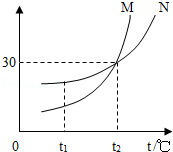
A.M的溶解度比N大
B.t1℃时,M接近饱和的溶液降低温度可以达到饱和
C.t2℃时,100g N的饱和溶液中溶解了30g N物质
D.t2℃时,M,N溶液的溶质质量分数相等
8.(3分)在“P+Q→盐和水”的反应中,物质P和Q不可能是( )
A.HCl,Ca(OH)2 B.SO2,NaOH C.Fe2O3,H2SO4 D.H2SO4,ZnCl2
9.(3分)下列叙述正确的是( )
A.乳酸(C3H6O3)中,碳氢氧三种元素的质量比是6:1:8
B.为了加快过滤速度,用玻璃棒搅拌漏斗内的液体
C.NaCl溶液中少量的NaNO3杂质,可用适量AgNO3溶液除去
D.3%的NaCl溶液中,溶质和溶剂的质量比为3:100
10.(3分)下列说法正确的是( )
A.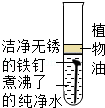
铁钉很快生锈 B.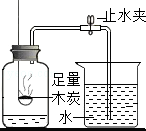
能用来检测空气中O2的含量
C.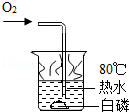
白磷能燃烧 D.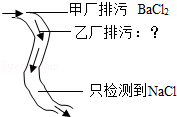
乙厂只排出Na2SO4
二、化学实验题(共3小题,满30分)
11.(10分)化学实验题
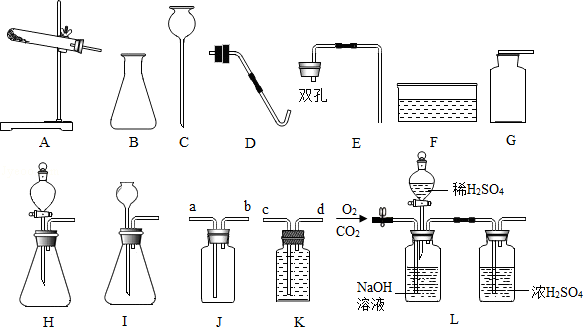
(1)仪器B的名称是 .
(2)写出用KClO3与MnO2的混合固体制取O2的化学方程式 ,需用到的仪器是 (写字母,可多选),那么除此之外还需要用到的仪器是 .
(3)实验室制取CO2的化学方程式是 .
(4)实验室常用块状固体电石(主要成分是CaC2)与水反应制取乙炔,该反应剧烈,速度较快,为了节约化学药品,则应选择的发生装置是 (填字母),通常情况下乙炔(C2H2)是一种无色、无味、密度比空气略小,难溶于水的气体,若要收集较纯净的乙炔气体,则应将气体从 (填a、b、c、或d)通入.
(5)将CO2和O2通入图L进行分离,最终得到的气体是 .
A.CO2、O2 B.CO2 C.O2 D.O2、H2O.
12.(11分)如图所示,A是氧化物,可作干燥剂;D是一种盐,用于制造玻璃,洗涤剂等,它们之间发生如图变化,请你根据所学的化学知识作出推断:
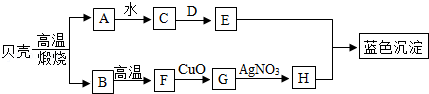
(1)A ,D ;
(2)贝壳的主要成分是 (写名称),贝壳高温煅烧的化学方程式 ;
(3)B F的化学方程式 ;E+H→蓝色沉淀的化学方程式是 反应.
F的化学方程式 ;E+H→蓝色沉淀的化学方程式是 反应.
(4)G H基本反应类型是 反应.
H基本反应类型是 反应.
(5)C的用途是 .
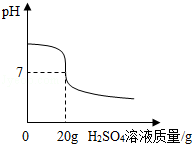
13.(9分)某小组欲用4.9%的稀H2SO4测一瓶标签破损的NaOH溶液的质量分数.
(1)从一瓶标签模糊的NaOH溶液里取出几滴后向 (填写溶液名称)里滴加,呈红色.
(2)取10g NaOH溶液样品,并与4.9%的稀硫酸溶液混合.由图可得,完全反应时,所用稀硫酸溶液中溶质的质量为 .
(3)求NaOH溶液样品中溶质的质量分数.
参考答案与试题解析
一、选择题(共10小题,每小题3分,满分30分)
1.(3分)以下是生活常见现象或结论,正确的是( )
A.为了加强农作物产量,要尽可能多的使用农药
B.工业排污水会造成水体污染
C.在室内放盆水能防止CO中毒
D.塑料是有机合成材料,不能把它投进带有 标志的垃圾桶
标志的垃圾桶
【分析】A、根据大量使用农药会造成环境污染,进行分析判断.
B、根据水体污染的原因进行分析判断.
C、根据一氧化碳难溶于水,进行分析判断.
D、根据塑料属于可回收物品,进行分析判断.
【解答】解:A、为了加强农作物产量,要尽可能多的使用农药,会造成环境污染,故选项说法错误.
B、工业排污水会造成水体污染,故选项说法正确.
C、一氧化碳难溶于水,在室内放盆水不能防止CO中毒,故选项说法错误.
D、塑料属于可回收物品,能把它投进带有 标志的垃圾桶,故选项说法错误.
标志的垃圾桶,故选项说法错误.
故选:B.
2.(3分)下列化学用语正确的是( )
A.2H2O:2个水分子 B.SO4:硫酸根离子
C.N2:2个氮原子 D.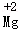 :镁离子
:镁离子
【分析】本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
【解答】解:A、化学式前面加上数字表示几个这样的分子,故2H2O表示2个水分子,故正确;
B、离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故硫酸根离子可表示为:SO42﹣;故错误;
C、N2表示氮气,2个氮原子可表示为:2N;故错误;
D、元素符号正上方标上数字表示元素的化合价,故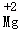 表示+2价的镁元素,故错误;
表示+2价的镁元素,故错误;
故选A
3.(3分)下列实验操作基本正确的是( )
A. B.
B.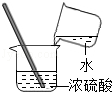 C.
C.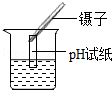 D.
D.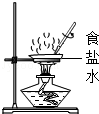
【分析】A、根据胶头滴管使用的注意事项分析;
B、运用稀释浓硫酸时不能将水倒入浓硫酸中要将浓硫酸倒入水中解答.
C、根据用pH试纸测定未知溶液的pH时的方法进行分析判断.
D、运用蒸发操作要领解答.
【解答】解:A、用滴管滴加液体时,应垂直悬空在烧杯口上方滴加液体,防止污染胶头滴管,故A错误;
B、稀释浓硫酸时不能将水倒入浓硫酸中要将浓硫酸倒入水中,防止水浮在浓硫酸的水面上沸腾溅出,故B错误;
C、不能将pH试纸直接浸入待测溶液中测酸碱性,以防止污染待测液,故C错误;
D、蒸发食盐要用玻璃棒不断搅拌,要外焰加热,故D正确.
故选:D.
4.(3分)下列说法正确的是( )
A.用水区分氯化铁,氯化钠,硝酸钾三种晶体
B.无色透明的液体都为溶液
C.品红在水中扩散,说明分子在不断运动
D.海水晒盐是化学变化
【分析】A、鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别;
B、无色透明的液体不一定是溶液;
C、根据分子是在不断运动的进行分析判断;
D、化学变化和物理变化的本质区别是否有新物质生成.
【解答】解:A、氯化铁溶于水溶液显黄色,氯化钠溶于水没有明显变化,硝酸钾溶于水没有明显变化,用水不可以鉴别,故错误.
B、无色透明的液体不一定是溶液,如水是无色透明的液体,但是纯净物.故错误.
C、品红在水中扩散,是因为品红中含有的分子是在不断运动的,向水中扩散,故正确.
D、海水晒盐的过程中没有新物质生成,属于物理变化,故错误.
故选:C
5.(3分)下列说法错误的是( )
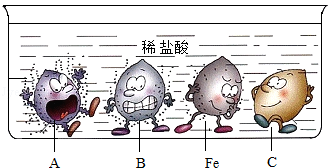
A.C可能是铜
B.将Fe放在B的盐溶液中可以置换出B
C.四种金属的活动性顺序是:A>B>Fe>C
D.钢和生铁都是铁合金
【分析】A、根据图示可知,C不与稀盐酸反应,据此进行分析判断.
B、根据图中B物质与稀盐酸反应比铁更剧烈,进行分析判断.
C、由图中金属与酸反应的剧烈程度,进行分析判断.
D、根据常见的铁合金的种类,进行分析判断.
【解答】解:A、由图示可知,C不与稀盐酸反应,C的位置排在氢的后面,可能是铜,故选项说法正确.
B、图中B物质与稀盐酸反应比铁更剧烈,说明了金属活动性B>铁;将Fe放在B的盐溶液中,不能发生置换反应,不能置换出B,故选项说法错误.
C、由图中金属与酸反应的剧烈程度,A反应最剧烈,B其次,C再次,C不与稀盐酸反应,则四种金属的活动性顺序是:A>B>Fe>C,故选项说法正确.
D、钢和生铁都是铁的合金,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,故选项说法正确.
故选:B.
6.(3分)某反应的微观示意图如下,下列说法正确的是( )
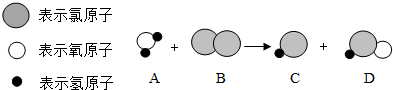
A.该反应说明原子在化学反应中可再分
B.反应物的分子个数比为3:2
C.所有参与反应的物质都是化合物
D.D物质中氯元素的化合价+1
【分析】根据反应的微观示意图,分析反应物、生成物,写出反应的化学方程式,根据方程式的意义分析判断即可.
【解答】解:由反应的微观示意图可知,该反应的化学方程式为:H2O+Cl2═HCl+HClO.
A、由微粒的变化可知,分子在化学变化中可以再分,原子不可再分,故A错误;
B、由方程式可知,反应物的分子个数比为1:1,故B错误;
C、由方程式可知,参与反应的氯气属于单质,故C错误;
D、D物质为HClO,由于氧显﹣2价,氢显+1价,由化合物中元素化合价的代数和为0可推出氯的化合价为+1价.故D正确.
故选D.
7.(3分)如图为M,N两种物质(不含结晶水)的溶解度曲线图,下列说法正确的是( )
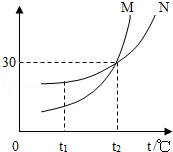
A.M的溶解度比N大
B.t1℃时,M接近饱和的溶液降低温度可以达到饱和
C.t2℃时,100g N的饱和溶液中溶解了30g N物质
D.t2℃时,M,N溶液的溶质质量分数相等
【分析】A、根据在比较物质的溶解度时,需要指明温度进行分析;
B、根据M物质的溶解度曲线进行分析;
C、根据饱和溶液的定义进行分析;
D、根据t2℃时,M,N溶液是否饱和进行分析.
【解答】解:A、固体物质的溶解度与温度有关,t2℃时,两种物质的溶解度相同,故A错误;
B、M物质的溶解度随温度的升高而减小,所以t1℃时,M接近保和的溶液降低温度可以达到饱和,故B正确;
C、t2℃时,M物质的溶解度是30g,100g应该是溶剂的质量,所以100g水中溶解了30gN物质,故C错误;
D、无法判断两种物质是否饱和,故D错误.
故选:B.
8.(3分)在“P+Q→盐和水”的反应中,物质P和Q不可能是( )
A.HCl,Ca(OH)2 B.SO2,NaOH C.Fe2O3,H2SO4 D.H2SO4,ZnCl2
【分析】根据题意,“P+Q→盐和水”的反应中,生成物是盐和水,据此结合酸的化学性质(能与金属氧化物、碱等反应反应生成盐和水)、碱的化学性质(能与非金属氧化物反应生成盐和水),进行分析解答即可.
【解答】解:A、盐酸与氢氧化钙反应生成氯化钙和水,生成物是盐和水,故选项错误.
B、二氧化硫与氢氧化钠反应生成亚硫酸钠和水,生成物是盐和水,故选项错误.
C、氧化铁与硫酸反应生成硫酸铁和水,生成物是盐和水,故选项错误.
D、硫酸与氯化锌交换成分没有沉淀、气体或水生成,不能发生复分解反应,故物质P和Q不可能是硫酸与氯化锌,故选项正确.
故选:D.
9.(3分)下列叙述正确的是( )
A.乳酸(C3H6O3)中,碳氢氧三种元素的质量比是6:1:8
B.为了加快过滤速度,用玻璃棒搅拌漏斗内的液体
C.NaCl溶液中少量的NaNO3杂质,可用适量AgNO3溶液除去
D.3%的NaCl溶液中,溶质和溶剂的质量比为3:100
【分析】A.根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答.
B.过滤液体时,要注意“一贴、二低、三靠”的原则.
C.根据物质的性质和除杂质的原则,所选的除杂剂不能与原物质反应,不能带入新的杂质,除杂剂与杂质反应后,能把杂质吸收或转化为便于和原物质分离的成分.
D.根据溶液中溶质的质量分数计算公式进行变形计算.
【解答】解:A.根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得乳酸中C、H、O元素的质量比为:(12×3):(1×6):(16×3)=6:1:8;故正确;
B.过滤实验中玻璃棒的作用是引流,用玻璃棒搅动漏斗里的液体,容易把滤纸弄破,起不到过滤的作用,故选项说法错误;
C.硝酸银和氯化钠反应,不与硝酸钠反应,除去的是氯化钠,故错误;
D.3%的NaCl溶液中,即100g溶液中溶质的质量为3g,那么溶质和溶液的质量比为3:100,溶质与溶剂的质量比为3:97,故错误.
故选A.
10.(3分)下列说法正确的是( )
A.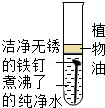
铁钉很快生锈 B.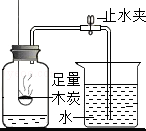
能用来检测空气中O2的含量
C.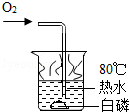
白磷能燃烧 D.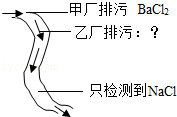
乙厂只排出Na2SO4
【分析】A.根据铁锈生锈的因素来分析;
B.根据测定空气中氧气含量的原理和方法来分析;
C.根据燃烧的条件来分析;
D.根据物质反应的规律来分析.
【解答】解:A.铁生锈的条件是:水和空气(或氧气),而A中煮沸的蒸馏水中无氧气或空气,所以不容易生锈,故错误;
B.木炭反应产生二氧化碳气体,不会使瓶内气体体积减小,不会使水进入集气瓶,故不能用木炭,故错误;
C.燃烧的条件是:可燃物、氧气、温度达到可燃物的着火点,白磷是可燃物,通入了氧气,其着火点只有40℃,温度已达到,所以会燃烧,故正确;
D.氯化钡溶液与硫酸钠溶液反应生成氯化钠和硫酸钡沉淀,乙厂有排出硫酸钠,同时也可以含有氯化钠,应该考虑物质的过量问题,故错误.
故选C.
二、化学实验题(共3小题,满30分)
11.(10分)化学实验题
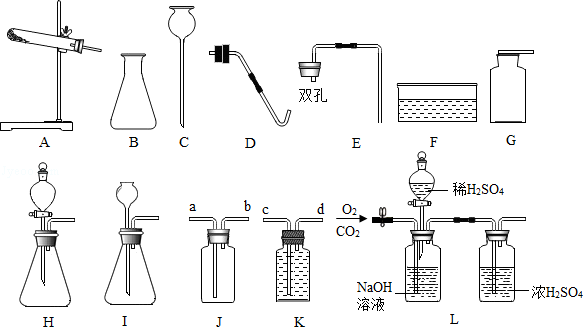
(1)仪器B的名称是 锥形瓶 .
(2)写出用KClO3与MnO2的混合固体制取O2的化学方程式 2KClO3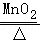 2KCl+3O2↑ ,需用到的仪器是 ADFG (写字母,可多选),那么除此之外还需要用到的仪器是 酒精灯 .
2KCl+3O2↑ ,需用到的仪器是 ADFG (写字母,可多选),那么除此之外还需要用到的仪器是 酒精灯 .
(3)实验室制取CO2的化学方程式是 CaCO3+2HCl═CaCl2+H2O+CO2↑ .
(4)实验室常用块状固体电石(主要成分是CaC2)与水反应制取乙炔,该反应剧烈,速度较快,为了节约化学药品,则应选择的发生装置是 H (填字母),通常情况下乙炔(C2H2)是一种无色、无味、密度比空气略小,难溶于水的气体,若要收集较纯净的乙炔气体,则应将气体从 d (填a、b、c、或d)通入.
(5)将CO2和O2通入图L进行分离,最终得到的气体是 A .
A.CO2、O2 B.CO2 C.O2 D.O2、H2O.
【分析】(1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据反应物的状态和反应条件确定实验室制取气体的发生装置,根据氧气的密度和溶水性确定气体的收集装置;
(3)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
(4)根据制取乙炔的反应中所使用药品的状态及反应发生的条件,判断制取该气体时所应选用的发生装置,根据该气体的密度及溶解性,判断收集装置;根据对反应的介绍,确定反应的反应物及生成物,写出反应的化学方程式;
(5)根据氢氧化钠会与二氧化碳反应,浓硫酸有吸水性进行分析.
【解答】解:(1)通过分析题中所指仪器的作用可知,B是锥形瓶;
(2)用KClO3与MnO2混合制取和收集纯净O2,反应物的状态是固态,反应条件是加热,所以发生装置选A、D;氧气不易溶于水,所以收集方法选排水法,收集纯净的氧气选F、G;氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3 2KCl+3O2↑;因为需要加热,所以还需要酒精灯;
2KCl+3O2↑;因为需要加热,所以还需要酒精灯;
(3)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)制取乙炔使用固体碳化钙与水在常温下发生反应,因此应选用固液不需加热型的发生装置B,由于乙炔(C2H2)是一种难溶于水、密度比空气略小、易燃烧的气体,因此收集时应选用图中装置D的排水法收集;乙炔难溶于水,所以要收集较纯净的乙炔气体,则应将气体从d端通入;
(5)将CO2和O2的混合气体通入图L进行分离,先关闭活塞打开止水夹,出来的是干燥的氧气;再关闭止水夹打开活塞,可得到干燥的二氧化碳.因此,将CO2和O2通入图L进行分离,最终得到的气体是二氧化碳和氧气两种都有,故选:A.
故答案为:(1)锥形瓶;
(2)2KClO3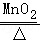 2KCl+3O2↑,ADFG,酒精灯;
2KCl+3O2↑,ADFG,酒精灯;
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)H,d;
(5)A.
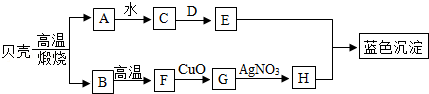
12.(11分)如图所示,A是氧化物,可作干燥剂;D是一种盐,用于制造玻璃,洗涤剂等,它们之间发生如图变化,请你根据所学的化学知识作出推断:
(1)A CaO ,D Na2CO3 ;
(2)贝壳的主要成分是 碳酸钙 (写名称),贝壳高温煅烧的化学方程式 CaCO3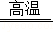 CaO+CO2↑ ;
CaO+CO2↑ ;
(3)B F的化学方程式 CO2+C
F的化学方程式 CO2+C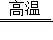 2CO ;E+H→蓝色沉淀的化学方程式是 2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3 反应.
2CO ;E+H→蓝色沉淀的化学方程式是 2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3 反应.
(4)G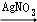 H基本反应类型是 置换 反应.
H基本反应类型是 置换 反应.
(5)C的用途是 改良酸性土壤 .
【分析】根据框图,从贝壳的成分是碳酸钙,高温煅烧生成氧化钙和二氧化碳,A是氧化物,可作干燥剂,所以A是氧化钙,B是二氧化碳,那C就是氢氧化钙,又D是一种盐,用于制造玻璃,洗涤剂等,故D是碳酸钠,E为氢氧化钠.二氧化碳在高温下与碳反应生成一氧化碳,故F为一氧化碳,在G为铜,H为硝酸铜.
【解答】根据框图,贝壳的成分是碳酸钙,高温煅烧生成氧化钙和二氧化碳,A是氧化物,可作干燥剂,所以A是氧化钙,B是二氧化碳,那C就是氢氧化钙,又D是一种盐,用于制造玻璃,洗涤剂等,故D是碳酸钠,E为氢氧化钠.二氧化碳在高温下与碳反应生成一氧化碳,故F为一氧化碳,在G为铜,H为硝酸铜.
(1)A是氧化钙,D碳酸钠,故填:CaO,Na2CO3;
(2)贝壳的主要成分是碳酸钙,高温分解生成氧化钙和二氧化碳,故填:碳酸钙,CaCO3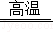 CaO+CO2↑;
CaO+CO2↑;
(3)B是二氧化碳,二氧化碳在高温下与碳反应生成一氧化碳,E为氢氧化钠,H为硝酸铜,E与H反应生成氢氧化铜蓝色沉淀和硝酸钠.故填:CO2+C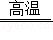 2CO,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;
2CO,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;
(4)G为铜,与硝酸银反应生成银和硝酸铜,属于置换反应,故填:置换;
(5)C是氢氧化钙,用途是改良酸性土壤.
13.(9分)某小组欲用4.9%的稀H2SO4测一瓶标签破损的NaOH溶液的质量分数.
(1)从一瓶标签模糊的NaOH溶液里取出几滴后向 酚酞 (填写溶液名称)里滴加,呈红色.
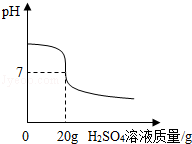
(2)取10g NaOH溶液样品,并与4.9%的稀硫酸溶液混合.由图可得,完全反应时,所用稀硫酸溶液中溶质的质量为 0.98g .
(3)求NaOH溶液样品中溶质的质量分数.
【分析】(1)根据酚酞是常用的酸碱指示剂分析回答;
(2)当溶液的pH=7时,酸碱恰好完全反应,根据稀硫酸的质量、质量分数求出稀硫酸溶液中溶质的质量;
(3)根据反应的方程式,由稀硫酸溶液中溶质的质量求出氢氧化钠的质量,再求出NaOH溶液样品中溶质的质量分数.
【解答】解:(1)酚酞是常用的酸碱指示剂,从一瓶标签模糊的NaOH溶液里取出几滴后向酚酞里滴加,呈红色;
(2)当溶液的pH=7时,酸碱恰好完全反应,由图象可知,所用稀硫酸的质量为20g,所用稀硫酸溶液中溶质的质量为:20g×4.9%=0.98g;
(3)设10gNaOH溶液样品中溶质的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 0.98g
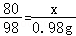 解得:x=0.8g
解得:x=0.8g
NaOH溶液样品中溶质的质量分数: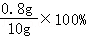 =8%
=8%
故答案为:(1)酚酞;(2)0.98g;(3)NaOH溶液样品中溶质的质量分数8%.
























![等级考试] 软考网络工程师闯关密卷讲解视频 2013-2015年 真题试卷答案及解析](https://static.kouhao8.com/sucaidashi/xkbb/df19200c0018d6b0be6f61852e7fe580.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)




相关资源