2015年广东省广州市中考化学试题及答案(WORD文档)
发布于 2021-09-02 16:39 ,所属分类:广东中考真题试卷及答案大全
2015年广东省广州市中考化学试题及答案
第一部分 选择题 共40分
一、选择题(本题包括20小题,每小题2分,共40分)
1.下列关于空气的说法正确的是( )
A.空气的主要成分是氮气和氧气
B.空气中氮气体积分数约为21%
C.空气中PM2.5含量高说明空气质量好
D.洁净的空气是纯净物
答案:
A
解析:
空气的主要成分是氮气和氧气,其中氮气占空气的体积分数约78%,氧气约为21%,稀有气体约为0.94%,二氧化碳约为0.03%,其他气体和杂质约占0.03%,属于混合物。PM2.5属于可吸入颗粒,可吸入颗粒是空气污染物监测的项目之一,含量越高说明空气质量越差。
2.下列变化中属于化学变化的是( )
A.把湿的衣服晒干 B.把水壶内水垢用食醋洗去
C.把石蜡加热熔化 D.把棉线织成布
答案:
B
解析:
生成其他物质的变化叫化学变化,没有生成其他物质的变化叫物理变化,即二者的本质区别是看是否有新物质生成。湿衣服晒干是水的蒸发,石蜡熔化是石蜡由固态变成液态,把棉线织成布,这三者都是属于物理变化。食醋除水垢是醋酸与水垢的成分(碳酸钙、氢氧化镁等物质)发生化学反应。
3.铝合金、氧化铝、硫酸铝三种物质的分类正确的是( )
A.混合物、氧化物、盐 B.单质、混合物、盐
C.盐、氧化物、纯净物 D.混合物、盐、化合物
答案:
A
解析:
混合物由两种或两种以上物质混合而成,如空气、食盐水(溶液)、大理石(主要成分碳酸钙)、合金等都属于混合物;氧化物由两种元素组成,其中一种元素为氧的化合物,氧化铝属于氧化物;由金属离子(以及铵根离子)与酸根离子结合成的化合物成为盐,硫酸铝属于盐。
4.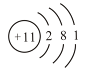 是某原子的结构示意图,下列关于该原子的描述正确的是( )
是某原子的结构示意图,下列关于该原子的描述正确的是( )
A.容易得到电子 B.属于非金属原子 C.核电荷数为11 D.最外层电子数为11
答案:
C
解析:
图示为钠原子的原子结构示意图。质子数=核电荷数=核外电子数。元素原子的最外层电子数小于4,易失电子,一般为金属元素。
5.下图表示广州市家用燃料使用的发展历程(括号内表示主要成分),下列说法错误的是( )
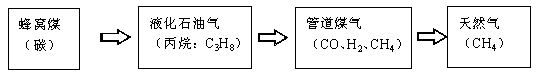
A.煤中主要含有碳元素,还含有氢、硫等元素,煤是清洁燃料
B.液化石油气是石油化工的一种产品
C.家用燃料燃烧时均放出热量
D.煤、石油、天然气都是化石燃料
答案:
A
解析:
煤主要含有C 元素,还含有少量的H、S 等元素,燃烧后会生成二氧化硫等污染性气体,二氧化硫能造成酸雨,因此煤不属于清洁燃料。
6.有关乙醇(C2H5OH)的说法正确的是( )
A.乙醇是食醋的主要成分
B.C2H5OH中C、H、O元素的质量比是2:6:1
C.乙醇不能溶于水
D.C2H5OH中C元素的质量分数是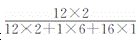
答案:
D
解析:
A项,食醋的主要成分是乙酸CH3COOH,乙醇的俗称是酒精;B项,乙醇分子中C、H、O 的原子个数比为2:6:1,C2H5OH中C、H、O元素的质量比是12:3:8;C项,乙醇与水能互溶。
7.下列化学反应属于复分解反应是( )
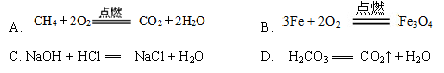
答案:
C
解析:
分解反应:由一种物质生成两种或两种以上其他物质的反应(特征:AB A+B)。
A+B)。
化合反应:由两种或两种以上物质生成另一种物质的反应(特征:A+B AB)。
AB)。
置换反应:由一种单质跟一种化合物反应,生成另一种单质和另一种化合物的反应(特征:A+BC AC+B)。
AC+B)。
复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应(特征:AB+CD AD+CB)。反应发生的条件:生成物要有沉淀或气体或水生成。
AD+CB)。反应发生的条件:生成物要有沉淀或气体或水生成。
8.常温下,下列说法错误的是( )
A.pH=2的溶液显酸性 B.pH=7的溶液显中性
C.溶液的pH由5变成2,其酸性减弱 D.pH>10的土壤不适于种植农作物,因为碱性太强
答案:
C
解析:
常温下,pH=7 时,溶液显中性;pH>7,溶液显碱性,且pH 值越大,溶液碱性越强;pH<7 时,溶液显酸性,pH 值越小,溶液酸性越大。植物一般生长在pH≈6.5-7.5 的土壤中。酸性太强或碱性太强均不适合植物生长。
9.如下图,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是( )
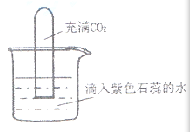
①试管内液面上升 ②试管内溶液变红 ③试管内液面不上升 ④试管内溶液变蓝
⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
答案:
A
解析:
二氧化碳能溶于水的,并且与水反应,使试管内的压强小于大气压,烧杯中水面上升;二氧化碳与水反应生成碳酸,碳酸溶液呈酸性,能使紫色石蕊变红。
10.下列关于物质性质及用途的描述中,错误的是( )
A.碳具有还原性,可冶炼金属 B.氧气具有氧化性,可作为燃料
C.氮气的化学性质稳定,可作为保护气 D.石灰石受热分解,可用于制备生石灰
答案:
B
解析:
A项,碳、氢气、一氧化碳均是具有还原性的物质,都可以用来冶炼金属;B项,氧气据有氧化性,可以作为助燃剂,并不能作为燃料;C项,氮气的化学性质不活泼,因此常用作保护气,如:焊接金属时常用氮气作保护气,灯泡中充氮气以延长使用寿命,食品包装袋内充氮气以防腐;D项,工业上用高温煅烧石灰石的方法来制备生石灰。
11.下列常见仪器的使用正确的是( )
A.量筒可用作中和反应的容器 B.烧杯加热时应放置在石棉网上
C.温度计可用于搅拌溶液 D.熄灭酒精灯,可用灯帽盖灭,也可用嘴吹灭
答案:
B
解析:
A 项,量筒只能作为量液体体积的仪器,不能最为反应容器或配制的容器;B项,烧杯、烧瓶等玻璃仪器由于底部面积比较大,在加热时必须垫石棉网,使之受热均匀;C项,温度计只能用于测量温度,如果用于搅拌可能会打破温度计;D项,熄灭酒精灯要用灯帽盖灭,熄灭后要提一提灯帽,若用嘴吹,由于往灯壶内吹入了空气,灯壶内的酒精蒸汽和空气在灯壶内迅速燃烧,形成很大气流往外猛冲,可能造成危险。
12.下列说法正确的是( )
A.CO(NH2)2 属于复合化肥
B.青少年正在长身体,应多吃富含蛋白质的肉类,不吃蔬菜
C.葡萄糖在人体内缓慢氧化,同时放出能
D.为了促进农作物的生长,可以大量施用化肥
答案:
C
解析:
A项,化肥的主要包括钾肥、氮肥、磷肥三种,含有氮、磷、钾三要素中两种和两种以上的肥料称为复合肥,CO(NH2)2属于氮肥;B项,人体重要的营养物质:糖类、油脂、蛋白质、维生素、无机盐和水六大类,通常称为六大营养素,蔬菜中含有大量的维生素,不能不吃;C项,能够给人体提供能量的营养素是:糖类、油脂和蛋白质;D项,化肥的使用要控制在合理的范围,过多施用容易造成土壤硬化,养分结构失调。
13.用下图所示装置探究燃烧的条件,有关该实验的说法正确的是( )
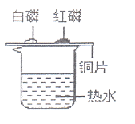
A.该实验只能得出燃烧需要氧气这一结论 B.该实验使用了相同的可燃物
C.该实验现象是铜片上的白磷不燃烧,红磷燃烧 D.该实验说明燃烧需要达到可燃物的着火点
答案:
D
解析:
由于红磷的着火点比白磷的着火点高,实验现象为白磷燃烧产生白烟,而红磷不燃烧。A项,通过该实验无法得出燃烧需要氧气这一结论。
14.保护环境,节约资源,从我做起。下列做法符合这一理念的是( )
A.生活污水直接排放到河涌中 B.垃圾分类回收处理
C.自来水价格便宜,可以尽情使用 D.废旧电池掩埋在土壤中
答案:
B
解析:
A项,生活污水的任意排放,大量的氮、磷等营养物质,造成水体富营养化,造成“水华”、赤潮等现象。C项,地球上水的储量是丰富的,但淡水资源短缺且分布不均匀,再加上近年来水污染现象的加重,所以我们必须爱护水资源。D项,固体废弃物埋入土壤的垃圾会破坏土壤。
15.下列物品所使用的材料中,不属于有机合成材料的是( )

答案:
C
解析:
三大合成材料:塑料、合成纤维、合成橡胶。
16.下列有关铁的说法错误的是( )
A.参考右图信息,铁的相对原子质量为26 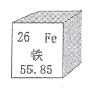
B.生铁和钢是常见的铁合金
C.铁钉在潮湿的空气中容易生锈,因此钢铁的使用要注意防锈
D.用赤铁矿高炉炼铁的化学反应方程式是Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
答案:
A
解析:
A项,“26”表示的是原子序数;“Fe”表示元素符号;“铁”表示元素名称,55.85为相对原子质量。B项,常见的铁合金 生铁(含碳量为2%~4.3%)、钢(含碳量为0.03%~2%)。C项,铁生锈的条件是氧气和水,所以钢铁在潮湿的空气中易生锈。D项,高炉炼铁的化学反应方程式是Fe2O3+3CO
生铁(含碳量为2%~4.3%)、钢(含碳量为0.03%~2%)。C项,铁生锈的条件是氧气和水,所以钢铁在潮湿的空气中易生锈。D项,高炉炼铁的化学反应方程式是Fe2O3+3CO 2Fe+3CO2。
2Fe+3CO2。
17.下列除去少量杂质的方法正确的是( )
A.Zn粉中含少量的ZnO:加入足量稀H2SO4充分反应后过滤
B.Cu(NO3)2溶液中含少量AgNO3:加入足量Cu屑充分反应后过滤
C.Na2SO4溶液中含少量H2SO4:加入足量Ba(OH)2充分反应后过滤
D.CaCO3固体中含少量Na2CO3:加入足量稀HCl充分反应后过滤
答案:
B
解析:
除杂原则:“不增、不减、不繁”。①“不增”就是不引入其他难以分离的其他物质;②“不减”就是不减少需要提纯的物质;③“不繁”就是整个实验操作简单易行。
A项,硫酸与Zn、ZnO都会发生反应,违背“不减”原则,A错误;B项,Cu+2AgNO3 2Ag+Cu(NO3)2,符合除杂原则,B正确;C项,Ba(OH)2与Na2SO4和H2SO4都会发生反应,违背“不减”原则,C错误;D项,HCl与CaCO3和Na2CO3都会发生反应,违背“不减”原则,D错误。
2Ag+Cu(NO3)2,符合除杂原则,B正确;C项,Ba(OH)2与Na2SO4和H2SO4都会发生反应,违背“不减”原则,C错误;D项,HCl与CaCO3和Na2CO3都会发生反应,违背“不减”原则,D错误。
18.下列有关实验操作的“先”与“后”的说法中,正确的是( )
A.制取气体时,先装药品,后检查装置的气密性
B.加热KClO3并用排水法收集O2实验结束时,先熄灭酒精灯,后移出导管
C.稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌
D.加热试管时,先使试管底部均匀受热,后用酒精灯的外焰固定加热
答案:
D
解析:
A项,制备气体时先检验气密性,再装药品;B项,制备氧气结束时,先撤导管,再熄灭酒精灯,防止水倒吸导致试管炸裂;C项,应该是先在烧杯中加水,再把浓硫酸沿杯壁缓慢倒入水中,并不断用玻璃棒搅拌,因为浓硫酸密度比水大,且稀释时放出大量热,若把水倒入浓硫酸会使水沸腾,发生危险;D项,加热试管时的注意事项,先均匀受热再用外焰固定加热。
19.从2H2+O2 2H2O中获取的信息错误的是( )
2H2O中获取的信息错误的是( )
A.在反应前后,元素的种类没有变化 B.在常温下氢气与氧气混合就可以发生反应
C.4g氢气与32g氧气完全反应,可以生成36g水 D.在反应前后,氢原子和氧原子的数目都没有改变
答案:
B
解析:
A项,根据质量守恒定律,化学反应前后元素的种类不变;B项,氢气和氧气的反应是在点燃条件下才可以发生;C 项,有反应方程式可以看出,在反应中氢气、氧气和水反应的质量比是1:8:9;D项,根据质量守恒定律,化学反应前后,原子的种类、数目和质量不变。
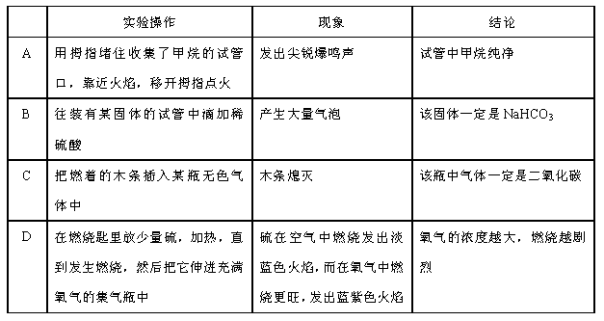
20.下列实验操作、现象与结论均正确的是( )
答案:
D
解析:
A 项,发出尖锐的爆鸣声,证明甲烷不纯,所以结论和现象不相符合;B项,和酸反应产生气体的固体不一定是碳酸氢钠,也有可能是氢前面的金属,也有可能是碳酸盐,所以实验现象和结论不符合;C项,能使燃着木条熄灭的气体除了二氧化碳还有氮气等,所以结论和现象不符合;D项,通过硫粉在空气中和纯氧中的燃烧的火焰颜色深浅不一样,从而得出了氧气浓度越大,燃烧越剧烈的结论。
第二部分 非选择题(共60分)
二、本题包括5小题,共32分
21.化学是在原子、分子的水平上研究物质及其变化规律。请回答下列关于水与过氧化氢(H2O2)的问题:
(1)H2O2中氧元素的化合价为__________。
(2)1个过氧化氢分子中含有__________个H,__________个O。
(3)写出下列反应的化学方程式:
①水通电后分解:____________________; ②过氧化氢分解:___________________。
(4)下列关于它们的说法正确的是__________(填编号)。
①水、过氧化氢组成元素相同,化学性质也相同
②过氧化氢溶于水得到的物质仍然属于纯净物
③水是生物体内重要的组成物质
④硬水可以使肥皂水产生更多的泡沫
答案:
(1)-1 (2) 2 2 (3)①2H2O 2H2↑+O2↑
2H2↑+O2↑
②2H2O2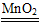 2H2O+O2↑ (4)③
2H2O+O2↑ (4)③
解析:
(1)过氧化氢中氢元素的化合价为﹢1 价,根据化合物中化合价代数和为零原则,所以氧元素的化合价为-1。
(2)1个过氧化氢分子由2个氢原子和2个氧原子构成。
(3)电解水和实验室用二氧化锰催化过氧化氢制备氧气的方程式。
(4)①分子不同,化学性质不同;②溶液是混合物;③水是生命之源,是生物体内重要的组成物质;④区分软水和硬水的方法:加入适量的肥皂水,振荡,泡沫较多的是软水,没有或少有泡沫,并有较多浮渣的是硬水。
22.(8分)盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,HCI由气态变为液态,从微观的角度分析该变化过程中改变的是 。
(2)在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是________________________________ __________ 。
②右图表示该反应前后溶液中存在的主要离子,
请写出每种图形代表的离子(填离子符号):

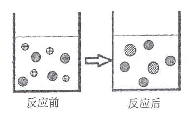
③下列金属中能与盐酸发生类似反应的是 (填选项)。
A.Cu B.Mg C.Al D.Ag
答案:
(1)分子的间隔 (2)①固体溶解,溶液由无色变为浅绿色,有气泡产生
②H+ 、Cl- 、Fe2+ ③ BC
解析:
(1)物质三态的变化属于物理变化,改变的是粒子之间的间隔。
(2)①固体溶解,溶液由无色变为浅绿色,有气泡产生。
②由方程式判断:Fe+2HCl FeCl2+ H2↑。
FeCl2+ H2↑。
③金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。位于氢前面金属可以置换出盐酸、稀硫酸中的氢,且金属的位置越靠前,金属活动性强。
23.(4分)下图为几种固体的溶解度曲线,回答下列问题:
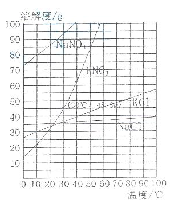
(1)NaCl的溶解度随温度变化的规律是_________________。
(2)30℃时,KNO3溶液的最大浓度(溶质质量分数)
为______________(只列计算式,不需要计算结果)。
(3)60℃时,10g NaCl和90g KNO3完全溶解于100g蒸馏水, 冷却到30℃后,_________(“有”或“没有”)NaCl析出, 有_______g KNO3结晶析出。
答案:
(1)溶解度受温度影响较小,且随温度的升高而增大
(2)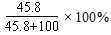
(3)没有 44.2
解析:
(1)由给出的溶解度曲线图可知,氯化钠的溶解度曲线是“平缓”型,但是依旧是随温度的升高而增大。
(2)饱和溶液中溶质质量分数: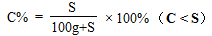 。
。
(3)通过溶解度曲线可知,在30℃时,NaCl的溶解度大于30g,因此没有氯化钠析出,KNO3的溶解度为45.8g,因此会有90g-45.8g=44.2g KNO3结晶析出。
24.(8分)碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2,待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为: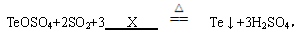 , 则X为________(填化学式)。
, 则X为________(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
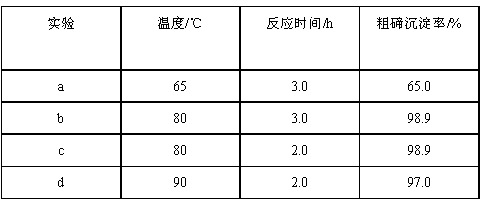
①该小组研究的反应条件是______________和_________________。
②实验a和b 的目的是___________________________。
③在上述四组实验中,最佳的反应条件是__________℃和__________h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是___________(填选项)。
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃, 2.0h
答案:
(1)H2O (2)①温度、反应时间 ②比较相同时间,不同的反应温度对粗碲沉淀率的影响 ③80℃ 、2.0h ④A
解析:
(1)根据质量守恒定律,化学反应前后相同原子的种类和个数不变,可得出X的化学式为H2O。
(2)①由数据可以知道,本实验研究反应条件是“温度”和“反应时间”这两个条件。
②由实验a 和实验b 对比,反应时间一样,反应的温度不一样,所以通过a 和b 实验
目的是“比较相同时间,不同的反应温度对粗碲沉淀率的影响”。
③在温度80℃ ,反应时间为2.0h 时粗碲的沉淀率最高。
④由表中数据可知,温度为80℃时,不管反应时间是2.0h 还是3.0h,粗碲的沉淀率最大都是为98.9%,所以可以缩减一下反应时间。
25.(6分)氢氧化钙俗称熟石灰,在生产和生活中有广泛的用途。
(1)熟石灰可由生石灰溶于水制得,反应的化学方程式是:________。测量其溶液的pH时,可以________,再用标准比色卡比较试纸显示的颜色,读取该溶液的pH。
(2)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是: 。
(3)用熟石灰来改良酸性土壤,反应的化学方程式是:________ (以土壤中含有硫酸为例)。
(4)用熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的KOH,反应的化学方程式
是_______。
②“黑白粉”还可提供植物必需的营养素是_______(填元素符号)。
答案:
(1)CaO+H2O Ca(OH)2 用玻璃棒蘸取少量样品滴到pH试纸上
Ca(OH)2 用玻璃棒蘸取少量样品滴到pH试纸上
(2)CO2+Ca(OH)2 CaCO3↓+ H2O
CaCO3↓+ H2O
(3)H2SO4+Ca(OH)2 CaSO4+2H2O
CaSO4+2H2O
(4)①Ca(OH)2 + K2CO3 CaCO3↓+ 2KOH ②K
CaCO3↓+ 2KOH ②K
解析:
(1)切不可将pH放入待测液中。
(2)CO2+Ca(OH)2 CaCO3↓+ H2O
CaCO3↓+ H2O
(3)中和反应的实际应用。
(4)按所含的营养元素分为氮肥、磷肥、钾肥和复合肥料(含有两种或两种以上的营养元素的化肥,如KNO3)。
三、本题包括4小题,共28分
26.(4分)实验室有如图所示装置,回答下列问题:
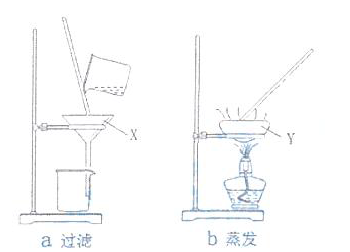
(1)填写仪器名称:X ;Y 。
(2)可以从食盐溶液中获得食盐固体的是 ,可以把粗盐浊液中的难溶物除去的是 (填编号)。
答案:
(1)漏斗 蒸发皿 (2)b a
解析:
蒸发溶剂可得到食盐固体,过滤可把难溶性物质与可溶性物质分离。
27.(11分)实验室部分装置如图所示,请回答下列问题。
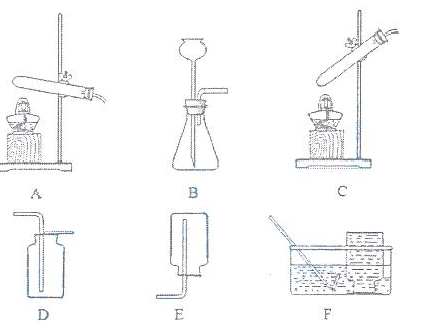
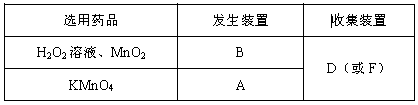
(1)选择发生和收集O2的装置,填写在下表中(填字母)。

(2)如果用MnO2与浓H2SO4加热制备O2,可选用的发生装置是 (填字母)。
(3)选用F装置收集气体时,下列实验操作正确的是 (填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(4)实验室用KMnO4制备O2的化学方程式是 。若需制备3.2g O2,至少需要消耗 gKMnO4..(已知KMnO4的相对分子质量为158)
答案:
(1)
(2)C (3)①②③
(4)2KMnO4 K2MnO4+MnO2+O2↑ 31.6
K2MnO4+MnO2+O2↑ 31.6
解析:
(1)A装置为固体加热制气装置,B装置为固体和液体不加热制气装置。氧气不与空气发生反应且密度比空气大,可用向上的排空气法收集,装置D;氧气不易溶于水,不与水反应,可用排水法收集,装置F。
(2)C装置为“固体+液体,加热型”制气装置。
(3)当出现连续均匀的气泡时,表明已将装置内的空气排尽。
(4)根据化学方程式进行计算。
28.(5分)配制并稀释一定质量分数的Na2SO4溶液。
(1)配制50g质量分数为6%的Na2SO4溶液。
①计算:需要Na2SO4 3.0g,水47.0g
②称量:用托盘天平称量3.0g的Na2SO4 。天平调零后,分别在天平左右托盘放上质量相同的纸片,先 ,然后 ,至托盘天平恰好平衡。
③量取:用量筒量取47.0mL水。请在右图中画出47.0mL水的液面位置。
④溶解。
(2)稀释溶液。(由于整个配制过程中溶液很稀,其密度可近似看做1g/mL)
①取1mL6%的Na2SO4溶液加水稀释至100mL,得到溶液a;
②若用3.0g Na2SO4配制与溶液a浓度相同的溶液,其体积是 mL。
答案:
(1)②在右盘添加3g砝码(或移动游码至3g) 向左盘添加硫酸钠固体
③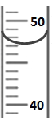
(2)5000
解析:
(1)用托盘天平称量药品时,根据“左物右码”的原则,先放砝码而后放固体至天平再次平衡。要保证凹液面的最低点与量筒上的47.0mL的刻度相切。
(2)根据稀释前后溶质的质量不变计算。
29.(8分)“低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”在食盐中用NaCl中按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2).
(1)测得某“低钠盐”样品a中含有NaCl和KCl的质量分数均为50%。该样品a的水溶液中,含量最多的离子是 (填离子符号)。
(2)探究某“低钠盐”样品b中是否添加镁盐,以及添加的是何种镁盐(MgSO4或MgCl2中的一种)。
请设计实验方案,完成下列表格。
限选试剂:BaCl2溶液、NaOH溶液、AgNO3溶液、蒸馏水
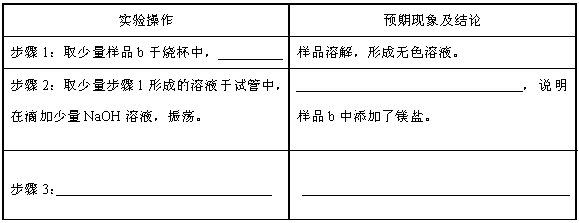
答案:
(1)Cl-
(2)
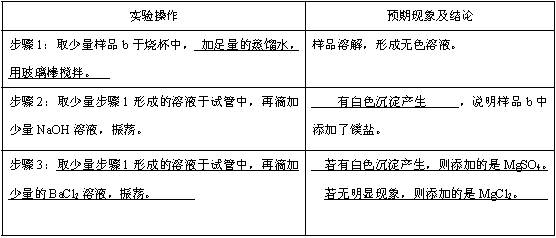
解析:
(1)NaCl 和KCl 都含有Cl-,所以Cl-最多。
(2)详见答案。
























相关资源