Nat Chem | 化学诱饵和捕法方法研究原位染色质相互作用组学
发布于 2021-03-31 11:16 ,所属分类:知识学习综合资讯

蛋白质-蛋白质相互作用介导关键的核功能,包括转录、染色质重塑和异染色质的建立和维持。蛋白质翻译后修饰相关的作用蛋白,需要使用强有力的方法在复杂的核环境中捕获微弱和短暂的蛋白质-蛋白质相互作用。这种调控的典型例子是与组蛋白的翻译后修饰(hPTMs)。利用各种化学蛋白质组学方法研究hPTM在天然染色质上的相互作用蛋白已经取得了进展。首先使用具有广泛反应性的交联试剂(如甲醛和BS3)共价捕获染色质结合蛋白。然后使用ChIP工作流程来富集感兴趣的hPTM,对相关的交联蛋白进行蛋白质组学分析。虽然操作简单,但这种方法固有地受到抗体交叉反应性的限制,可能导致假阳性,以及由结合的读取器蛋白或存在相邻hPTMs引起的表位封闭问题,两者都导致假阴性。光交联为捕捉活细胞中蛋白质相互作用提供了另一种方法。这可以通过非特异性地将光交联氨基酸并入蛋白质组,或者利用琥珀抑制技术在感兴趣的蛋白质中的特定位点添加探针来实现。超快分裂蛋白的使用有助于化学定义的hPTMs和交联剂的安装,并具有空间和时间控制。在这里,作者提出了一种合成方法原位组装化学修饰染色质。
首先,作者设想了一种化学蛋白质组学策略,利用分裂内肽介导的蛋白质反式剪接(PTS)来修饰分离的细胞核中的染色质。原则上,这种蛋白质半合成方法应允许同时将一个或多个hPTM、近端光交联剂和生物素亲和手柄引入选择的组蛋白中。此过程中,在天然染色质中产生hPTM调控的光亲和陷阱(图1)。
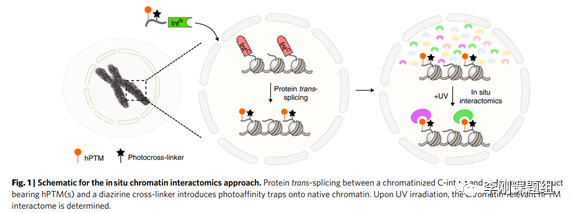
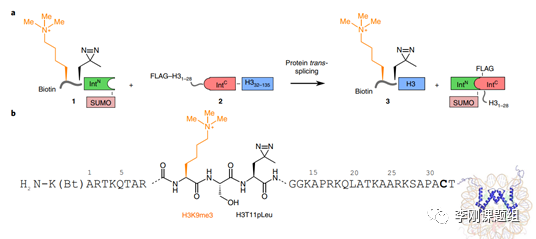
Fig. 2 In situ installation of hPTMs with ultra-fast split inteins. (a), Proteintrans-splicing between delivered material 1 and expressed construct 2 resultsin the semisynthetic histone 3 bearing H3K9me3 with an adjacent photocross-linker(H3T11pLeu). (b), Expanded view of splice product 3 installing H3K9me3 andH3T11pLeu into native chromatin (Bt, biotin).
下一步作者转向全蛋白质组分析,实施了一个基于SILAC的工作流程来确定hPTM的原位相互作用蛋白-蛋白质组, H3K9me3(图3a)。将Intein–histone fusion 2转染到HEK 293T细胞中,该细胞生长在“重”(H)或“轻”(L)同位素标记的SILAC培养基中。分离纯化细胞核,进行PTS反应,将带有H3K9me3的尾部或野生型H3尾部安装到天然染色质上。从系统中清洗过多的传递结构后,用紫外光照射细胞核以交联相互作用的蛋白质。通过剪切将染色质剪切成大约单核小体和双核小体。采用生物素免疫沉淀法(IP)分离H3修饰蛋白和交联蛋白,然后进行胰蛋白酶珠上消化、脱盐和LCMS/MS分析。





![[CCNA RS] 安德讲师2014最新CCNAv2.0至强版课程29-NAT和PPPoE](https://static.kouhao8.com/sucaidashi/xkbb/d74a04e1882f910cbab5bf89df04df7f.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)


![[CCNA RS] 基础视频 韩立刚CCNA实战视频教程 CiscoIOS IP地址划分 静态动态路由 ACL和NAT配置](https://static.kouhao8.com/sucaidashi/xkbb/82418b38a92d6a1b423bd4304050a190.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)


















相关资源