高中化学:四大平衡归纳总结,请查收!
发布于 2021-04-12 14:59 ,所属分类:知识学习综合资讯

高中化学教材中,有一个平衡理论体系,包括溶解平衡、化学平衡、电离平衡、水解平衡、络合平衡等。
化学平衡是这一平衡理论体系的核心。系统掌握反应速率与化学平衡的概念、理论及应用对于深入认识其他平衡,重要的酸、碱、盐的性质和用途,化工生产中适宜条件的选择等,具有承上启下的作用;
对于深入掌握元素化合物的知识,具有理论指导意义。正因为它的重要性,所以,在历年高考中,这一部分向来是考试的热点、难点。
1.高中化学常见四大平衡

2.常见四大平衡研究对象
模型一、化学平衡
研究对象:可逆反应。如:
加热不利于氨的生成,增大压强有利于氨的生成。
模型二、电离平衡:
研究对象:弱电解质。如: 加热促进电离,稀释电离度增大。
加热促进电离,稀释电离度增大。
模型三、水解平衡
研究对象:弱酸盐或弱碱盐或弱酸弱碱盐。如: 配制
配制 溶液应加入少量酸防止
溶液应加入少量酸防止 水解。不断加热
水解。不断加热 溶液,蒸干灼烧可得到
溶液,蒸干灼烧可得到 固体。
固体。
模型四、溶解平衡
研究对象:气体或固体溶于水形成的饱和溶液中形成的平衡体系。
(1)气体的溶解平衡
如: 当加入
当加入
等时平衡会发生移动。当收集 等气体时往往分别通过饱和的
等气体时往往分别通过饱和的
 等溶液以除去可能有的酸性气体,且抑制气体的溶解。
等溶液以除去可能有的酸性气体,且抑制气体的溶解。
(2)固体的溶解平衡如:
如: 加热促进溶解;
加热促进溶解; 加热溶解度降低;
加热溶解度降低; 反应的进行是由于
反应的进行是由于 存在溶解平衡;
存在溶解平衡; ;由于
;由于 能水解,加热时
能水解,加热时 的水解程度增大,促进了
的水解程度增大,促进了 的溶解,最终
的溶解,最终 转化成
转化成 。
。
知识结构



归纳总结
四大平衡无论是理论学习还是解题方法,都有许多的共通之处。归纳总结四大平衡的共同点是一种有效的复习方法。


1.所有的平衡都建立在“可逆反应”的基础上

2.平衡特征相同

3.都可借助v-t图学习平衡的建立及平衡的移动




4.都能用勒夏特列原理解释平衡的移动
勒夏特列原理:如果改变影响平衡的一个条件(如温度、浓度、压强等),平衡就向减弱这个改变的方向移动.
平衡的实质是两个变化方向的速率相等,所以影响平衡的因素首先是影响速率的因素:
(1)温度:升温促进吸热过程进行

(2)浓度:增大某物质浓度,平衡向消耗该物质的方向移动
(3)减压或稀释

5. 都存在平衡常数K

高考分析
化学平衡


2.电离平衡


3.水解平衡

4.溶解平衡

标签:高中化学 高考化学
问题:资料,合作等问题,首页对话框回复关键字(非留言)
声明:本文来源网络,版权归原作者,如有侵权请联系小编删除!







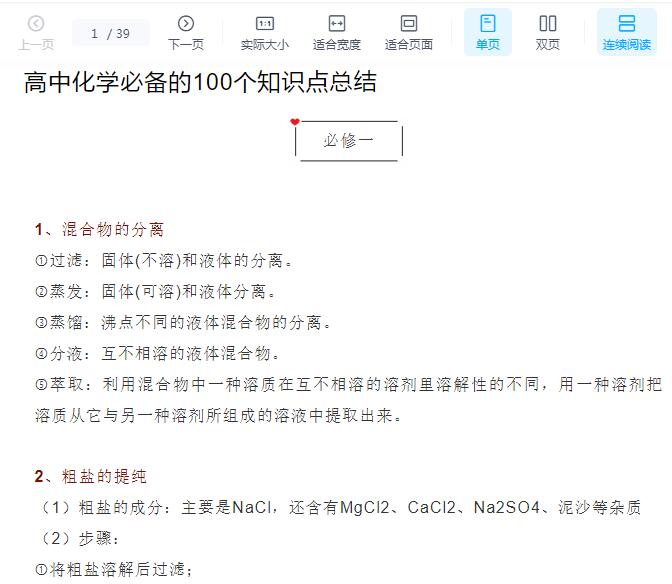
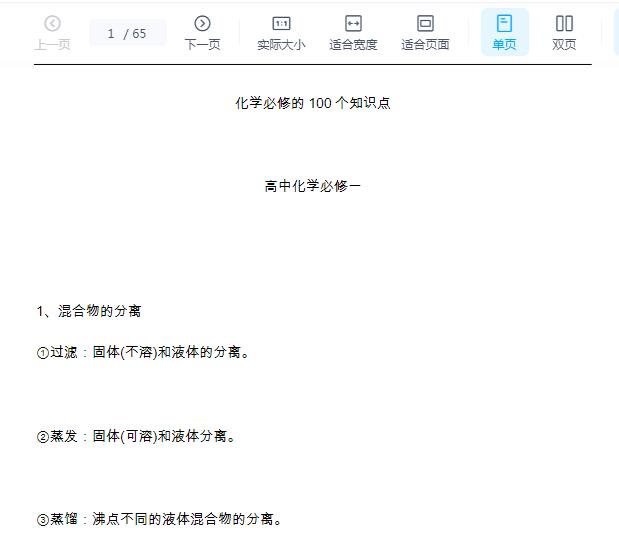
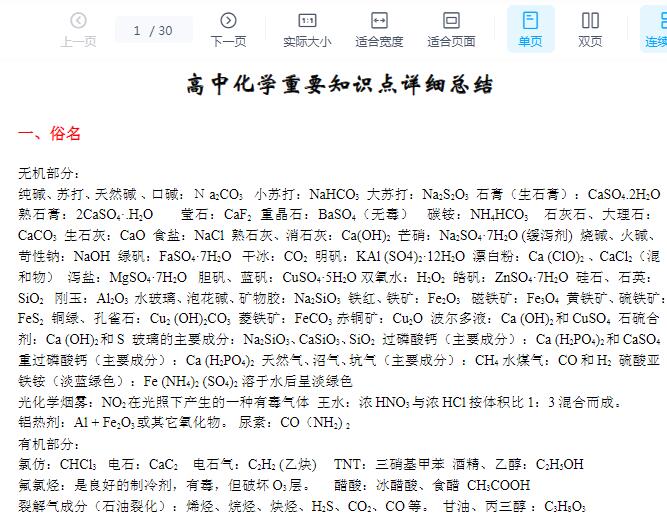



![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)








相关资源