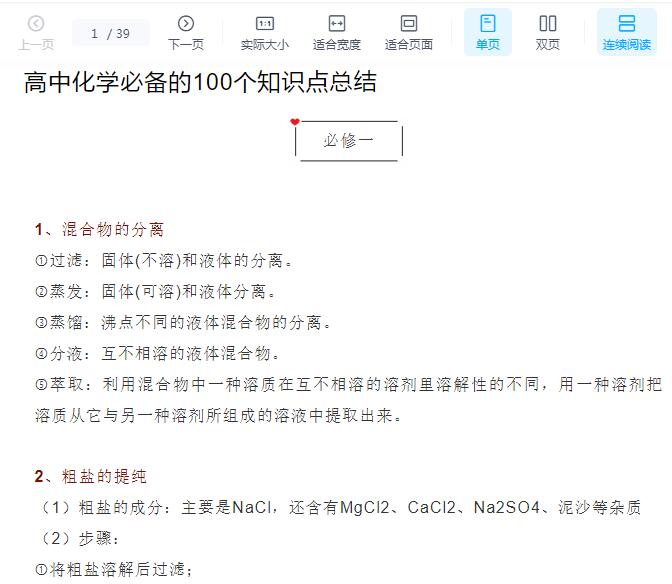
高考必备!高中化学教材中工艺流程题的十大难点总结!
发布于 2021-04-12 15:35 ,所属分类:知识学习综合资讯


1.从铝土矿中提炼铝
流程Ⅰ:
(1)涉及反应(写出并配平化学方程式)
①Al2O3+6HCl=2AlCl3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
②AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
HCl+NaOH=NaCl+H2O
③NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3
NaOH+CO2=NaHCO3
④Al(OH)3△Al2O3+3H2O
⑤Al2O3(熔融)电解4Al+3O2↑
(2)问题探讨(思考并回答问题)
①步骤①加入过量盐酸后的实验操作是什么?
提示:过滤。
②步骤②能否用氨水代替NaOH溶液?
提示:不能;原因是Al3+与过量氨水反应生成Al(OH)3沉淀,达不到分离Al3+、Fe3+的目的。
③步骤③中若将CO2的量改为“少量”,得到的产物还是NaHCO3吗?
提示:不是NaHCO3而是Na2CO3。
流程Ⅱ:
(1)涉及反应
①Al2O3+2NaOH=2NaAlO2+H2O
SiO2+2NaOH=Na2SiO3+H2O
②Na2SiO3+2HCl=H2SiO3↓+2NaCl
NaAlO2+4HCl=NaCl+AlCl3+2H2O
NaOH+HCl=NaCl+H2O
③AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
HCl+NH3·H2O=NH4Cl+H2O
(2)问题探讨
①步骤②中将盐酸改为“CO2”合适吗?为什么?
提示:不合适;因为过量CO2与NaAlO2、Na2SiO3反应生成Al(OH)3和H2SiO3沉淀,达不到分离SiO和AlO的目的。
②步骤③中将氨水改为“NaOH溶液”合适吗?
提示:不合适;因为Al(OH)3能溶于NaOH。
③冶炼金属铝能否用氯化铝代替氧化铝?
提示:不能;因为AlCl3属于共价化合物。
2.硅的制备
石英砂 ①焦炭高温 粗硅 ②Cl2加热 四氯化硅 ③H2高温 纯硅
(1)涉及反应
①SiO2+C高温Si+CO↑
②Si+Cl2加热SiCl4
③SiCl4+2H2高温Si+4HCl
(2)问题探讨
①步骤①中石英砂与焦炭高温下反应时为什么要隔绝空气?
提示:高温下,焦炭和空气中的O2发生反应。
②用石英砂和焦炭制备粗硅的反应中,焦炭的作用是什么?
提示:提供能量,作还原剂。
③粗硅与HCl完全反应后,经冷凝得到的SiCl4(沸点57.6 ℃)中混有少量的SiHCl3(沸点33 ℃),提纯SiCl4采用的方法是什么?
提示:蒸馏。
④由SiO2与C高温下反应得到的粗硅中可能含有什么杂质?
提示:SiO2、C、SiC等。
3.氯碱工业
(1)涉及反应
①2NaCl+2H2O电解,2NaOH+H2↑+Cl2↑
②Cl2+2NaOH=NaCl+NaClO+H2O
③2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
④H2+Cl2点燃,2HCl
(2)问题探讨
①食盐中含有Ca2+、Mg2+、SO等杂质离子,如何设计实验方案除去这些杂质离子?
②工业上电解食盐水制烧碱时,食盐水为什么必须要精制?
提示:精制食盐水的目的是除去食盐水中的Ca2+、Mg2+、SO等杂质离子,以防Mg2+与OH-结合生成Mg(OH)2堵塞隔膜电解槽中的隔膜,造成电解失败。
③用惰性电极电解饱和食盐水时,为什么要用隔膜把电解槽分成阳极室、阴极室?
提示:电解时,阳极产生Cl2,阴极产生H2,若无隔膜,二者混合光照时会发生爆炸,隔膜的作用是将H2和Cl2隔开,以防发生危险。
④步骤③制取漂白粉时是将Cl2通入澄清石灰水中吗?
提示:不是;原因是澄清石灰水中Ca(OH)2的含量低,不适合工业大量生产,应改为石灰乳。
4.工业上利用黄铁矿(FeS2)制取硫酸
(1)涉及反应
①FeS2+O2高温Fe2O3+SO2
②SO2+O2催化剂△SO3
③SO3+H2O=H






![高考必刷!十大专题PDF文档带你冲刺历史![百度网盘资源]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230505ml2/22-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)



![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)

![高中化学物理生物挑战押题[百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/103-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)


相关资源