初中化学十二类重要规律知识总结,一轮复习必背!
发布于 2021-04-11 12:14 ,所属分类:知识学习综合资讯

金属活动性顺序由强至弱:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(按顺序背诵) 钾钙钠镁铝 锌铁锡铅(氢) 铜汞银铂金
1.金属位置越靠前的活动性越强,越易失去电子变为离子,反应速率越快。
2.排在氢前面的金属能置换酸里的氢,排在氢后的金属不能置换酸里的氢,跟酸不反应。
3.排在前面的金属,能把排在后面的金属从它们的盐溶液里置换出来。排在后面的金属跟排在前面的金属的盐溶液不反应。
4.混合盐溶液与一种金属发生置换反应的顺序是“先远”“后近”。
注意:*单质铁在置换反应中总是变为+2价的亚铁离子。
1.等质量金属跟足量酸反应,放出氢气由多至少的顺序:Al>Mg>Fe>Zn。
2.等质量的不同酸跟足量的金属反应,酸的相对分子质量越小放出氢气越多。
3.等质量的同种酸跟足量的不同金属反应,放出的氢气一样多。
水银不是银是汞;铅笔不是铅是石墨;纯碱不是碱是盐(碳酸钠);塑钢不是钢是塑料。
1.酸(H+)检验
方法1:将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变红,则证明H+存在。
方法2:用干燥清洁的玻璃棒蘸取未知液滴在蓝色石蕊试纸上,如果蓝色试纸变红,则证明H+的存在。
方法3:用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH小于7,则证明H+的存在。
2.碱(OH-)的检验
方法1:将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变蓝,则证明OH-的存在。
方法2:用干燥清洁的玻璃棒蘸取未知液滴在红色石蕊试纸上,如果红色石蕊试纸变蓝,则证明OH-的存在。
方法3:将无色的酚酞试液滴入盛有少量待测液的试管中,振荡,如果酚酞试液变红,则证明OH-的存在。
方法4:用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH大于7,则证明OH-的存在。
3.CO32-或HCO3-的检验
将少量的盐酸或硝酸倒入盛有少量待测物的试管中,如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试管中,如果石灰水变浑,则证明原待测物中CO32-或HCO3-的存在。
4.铵盐(NH4+)
用浓NaOH溶液(微热)产生使湿润的红色石蕊试纸变蓝的气体。
1.金属的相对原子质量>新金属的相对原子质量时,反应后溶液的质量变重,金属变轻。
2.金属的相对原子质量<新金属的相对原子质量时,反应后溶液的质量变轻,金属变重。
3.在金属+酸→盐+H2↑反应后,溶液质量变重,金属变轻。
1.氧气的浓度不同,生成物也不同。如:碳在氧气充足时生成二氧化碳,不充足时生成一氧化碳。
2.氧气的浓度不同,现象也不同。如:硫在空气中燃烧是淡蓝色火焰,在纯氧中是蓝色火焰。
3.氧气的浓度不同,反应程度也不同。如:铁能在纯氧中燃烧,在空气中不燃烧。
4.物质的接触面积不同,燃烧程度也不同。如:煤球的燃烧与蜂窝煤的燃烧。
1.搅拌或振荡。搅拌或振荡可以加快物质溶解的速度。
2.升温。温度升高可以加快物质溶解的速度。
3.溶剂。选用的溶剂不同物质的溶解性也不同。
1.同一周期中的元素电子层数相同,从左至右核电荷数、质子数、核外电子数依次递增。
2.同一族中的元素核外电子数相同、元素的化学性质相似,从上至下核电荷数、质子数、电子层数依次递增。
1.质子数决定原子核所带的电荷数(核电荷数),因为原子中质子数=核电荷数。
2.质子数决定元素的种类。
3.质子数、中子数决定原子的相对原子质量,因为原子中质子数+中子数=原子的相对原子质量。
4.电子能量的高低决定电子运动区域距离原子核的远近,因为离核越近的电子能量越低,越远的能量越高。
5.原子最外层的电子数决定元素的类别,因为原子最外层的电子数<4为金属,>或=4为非金属,=8(第一层为最外层时=2)为稀有气体元素。
6.原子最外层的电子数决定元素的化学性质,因为原子最外层的电子数<4为失电子,>或=4为得电子,=8(第一层为最外层时=2)为稳定。
7.原子最外层的电子数决定元素的化合价,原子失电子后元素显正价,得电子后元素显负价,化合价数值=得失电子数。
8.原子最外层的电子数决定离子所带的电荷数,原子失电子后为阳离子,得电子后为阴离子,电荷数=得失电子数。
1.使用托盘天平时,首先要调节平衡。调节平衡时,先把游码移到零刻度,然后转动平衡螺母到达平衡。
2.加热使用试管或烧瓶给药品加热时,先预热,然后集中加热。


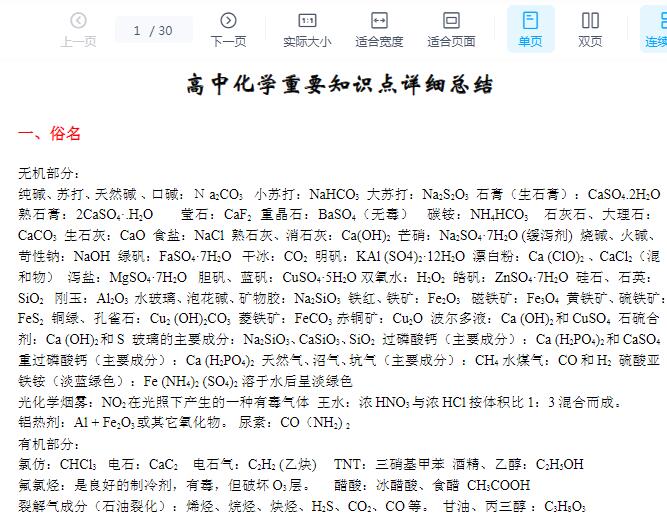


![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)









相关资源