【高中化学】难写的化学方程式归纳总结!
发布于 2021-03-24 14:32 ,所属分类:知识学习综合资讯

非氧化还原反应
1.若实验室用CaO和碳铵作原料制取氨气,用一个化学方程式表示反应原理。
[解析]NH4HCO3热分解的产物是NH3、CO2和H2O,CaO既吸收CO2又吸收H2O。
NH4HCO3+2CaO=NH3↑+CaCO3+Ca(OH)2
2.“在溶液中发生的离子互换反应一般总是向离子浓度减少的方向进行。”此话实际上是存在少数反例的。请举一个典型反例,用化学反应方程式(或离子方程式)表示。
[答]NH3·H2O+CH3COOH→NH4++CH3COO-+H2O
3.在Na2S溶液中通入过量CO2,反应产物是_________和_________。
[解析] 虽说碳酸的酸性强于H2S,不至于在该反应中产生H2S和Na2CO3。一般而言,多元酸的正盐与酸(包括弱酸)是不能共存的。反应产物是NaHS和NaHCO3。
4.将0.3mol/L NaOH溶液和0.1mol/l Ca(H2PO4)2溶液等体积混合,充分搅拌后静置,反应充分进行。写出此反应的离子方程式。
[解析] NaOH与Ca(H2PO4)2 3:1反应。Na+实际不参加反应。
3OH- + Ca2+ +2H2PO4-
H2O是最弱的电解质,所以它常常是离子反应中的第一产物。本例中有3份OH-,顶多产生3份H2O。
3OH-+ Ca2++2H2PO4-→3H2O
剩余微粒尚有1份Ca2+、1份HPO42-和1份PO43-。先组合成最难溶的Ca3(PO4)2(1/3份),还剩1/3份PO43-和1份HPO42-,
3OH-+ Ca2++2H2PO4-→ 3H2O+1/3 Ca3(PO4)2↓+1/3 PO43-+HPO42-
两边乘3,结果是:
3Ca2++6H2PO4-+ 9OH-= Ca3(PO4)2↓+PO43-+3HPO42-+ 9H2O
5.BiCl3水解生成BiOCl。
(1)写出水解的化学方程式。(2)有人将BiOCl叫做次氯酸铋,你认为这有什么不妥之处?
[解析] 水解的前提是H2O一解为二。比较熟悉的是“全水解”(如AlCl3):BiCl3+3H2O=Bi(OH)3+3HCl
实际上BiCl3还留了一个Cl,看来只与两个OH-发生了交换:BiCl3+2H2O=Bi(OH)2Cl+2HCl
碱式盐脱水成了BiOCl,结果是:BiCl3+H2O=BiOCl+2HCl
BiOCl是一种碱式盐,其中的Cl显-1价,而次氯酸中的Cl应是+1价。(如果有次氯酸铋这种盐的话,其化学式应是Bi(ClO)3。)
6.Na2S2O3溶液与Al2(SO4)3溶液混合,写出发生反应的离子方程式。
[解析] 已知Na2S2O3在酸性条件下发生“歧化”生成SO2和S,Al2(SO4)3在此起的就是酸化作用:Al3++3H2O≒Al(OH)3+3H+
答:3S2O32-+2Al3++3H2O=3SO2↑+2Al(OH)3↓+3S↓
7 .碳酰氯也叫光气,遇水可发生水解,在氨中可发生氨解。分别写出碳酰氯的水解、氨解反应化学方程式。
[解析] 水解是将H2O一解为二,氨解则是将NH3一解为二(成为-NH2和-H)
COCl2+H2O→2HCl+CO2 ; COCl2+4NH3→CO(NH2)2+2NH4Cl
8.固体V2O5是两性氧化物,在强酸性溶液中以钒氧基离子(VO2+)形式存在,在强碱性溶液中以钒酸根离子(VO3-)形式存在。VO2+具有强氧化性,能将Cl-氧化为Cl2,本身被还原成VO+。写出V2O5溶于下列溶液中发生反应的离子方程式。
(1)溶于硫酸
(2)溶于氢氧化钠溶液
(3)溶于盐酸
[答] (1)或V2O5+2H+→2VO2++H2O;
(2)或V2O5+2OH-→2VO3-+H2O;


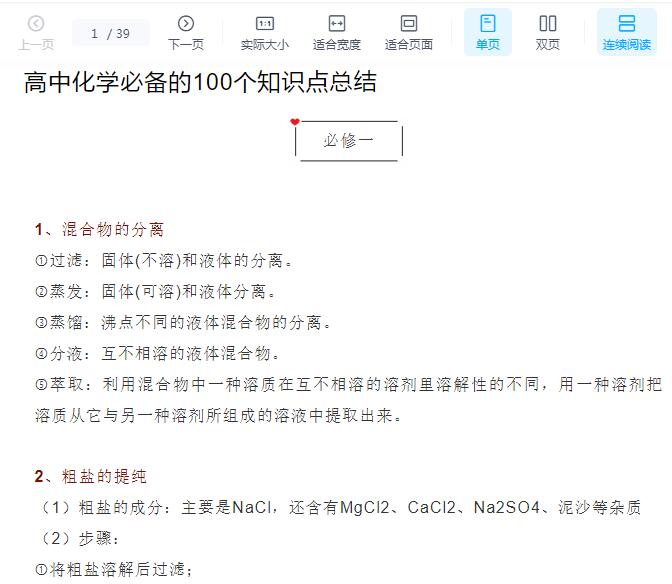
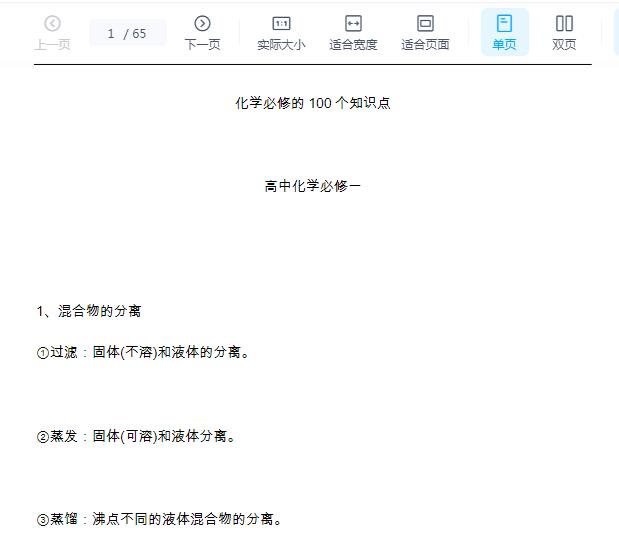

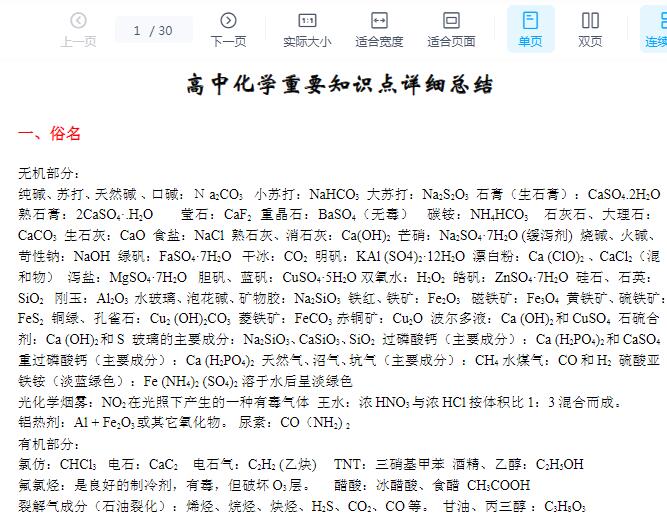
![高中化学常考100个重要知识点总结![百度网盘分享]](https://static.kouhao8.com/cunchu/cunchu7/2023-05-18/UpFile/defaultuploadfile/230430ml/138-1.jpg?x-oss-process=image/format,webp/resize,w_88/crop,w_88,h_88,g_nw)


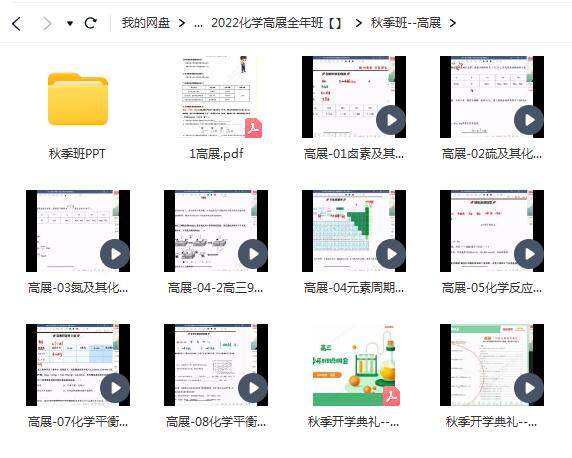
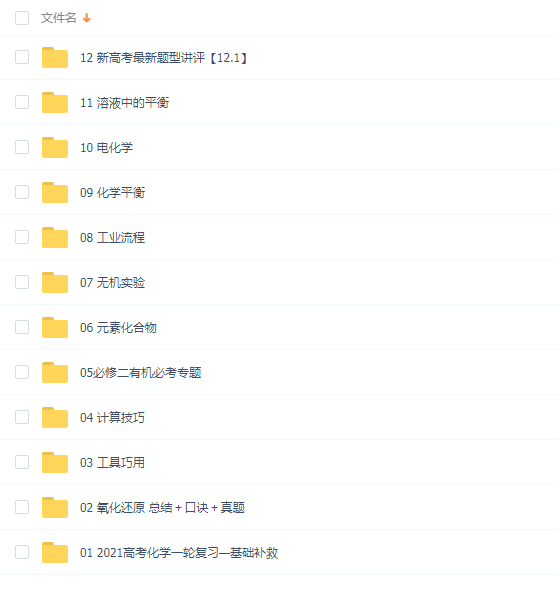
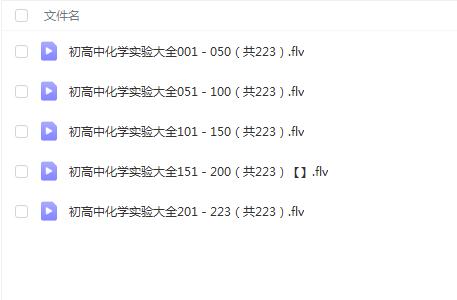
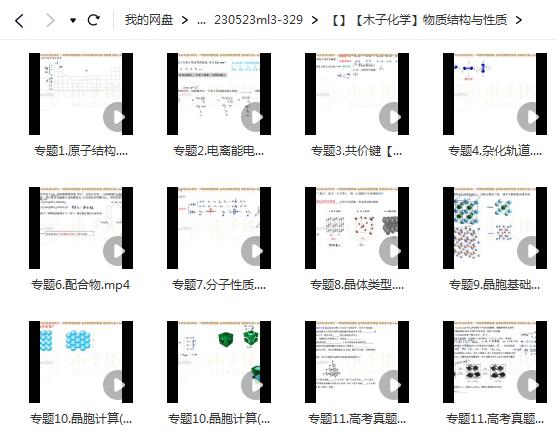



相关资源